Nuvigil: Túlzott álmosságkezelés (az alkalmazással kapcsolatos információk)
Márkanév: Nuvigil
Általános név: armodafinil
Nuvigil® (armodafinil) tabletta [C-IV]
Az armodafinil olyan gyógyszer, amely elősegíti az ébrenlétet, és amely Nuvigilként kapható alvási apnoe, narkolepszia vagy műszakos munka alvási rendellenesség kezelésére. Használat, adagolás, mellékhatások.
Tartalom:
Leírás
Klinikai farmakológia
Klinikai vizsgálatok
Javallatok és felhasználás
Ellenjavallatok
figyelmeztetések
óvintézkedések
Mellékhatások
Kábítószer-visszaélés és függőség
Overdose
Adagolás és adminisztráció
Hogyan szállították
A Nuvigil betegtájékoztatója (egyszerűen angolul)
Leírás
NUVIGIL® (armodafinil) az ébrenlét fokozására szolgáló szer orális alkalmazásra. Az armodafinil a modafinil R-enantiomerje, amely az R- és S-enantiomerek keveréke. Az armodafinil kémiai neve 2 - [(R) - (difenil-metil) -szulfinil] -acetamid. A molekuláris képlet C15H15NEM2S és a molekulatömeg 273,35.
A kémiai szerkezet:
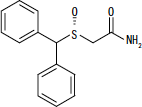
Az armodafinil fehér vagy törtfehér, kristályos por, amely vízben nagyon kevéssé oldódik, acetonban mérsékelten oldódik, és metanolban oldódik. A NUVIGIL tabletta 50, 150 vagy 250 mg armodafinilt és a következő inaktív összetevőket tartalmaz: kroszkarmellóz nátrium, laktóz-monohidrát, magnézium-sztearát, mikrokristályos cellulóz, povidon és előzselatinizált keményítő.
felső
Klinikai farmakológia
A hatásmechanizmus és a farmakológia
A pontos mechanizmus (ok), amelyeken keresztül az armodafinil (R-enantiomer) vagy a modafinil (az R- és S-enantiomerek keveréke) elősegíti az ébrenlétét, nem ismert. Mind az armodafinil, mind a modafinil hasonlóak farmakológiai tulajdonságokat mutattak a nem klinikai állatkísérletekben és in vitro vizsgálatokban, a tesztelt mértékben.
folytasd a történetet az alábbiakban
Farmakológiai szempontból releváns koncentrációk esetén az armodafinil nem kötődik vagy gátolja számos receptor és enzim potenciálisan releváns alvás / ébresztés szabályozása, ideértve a szerotonin, a dopamin, az adenozin, a galanin, a melatonin, a melanokortin, az orexin-1, az orfanin, a PACAP vagy benzodiazepinek vagy GABA, szerotonin, norepinefrin és kolin vagy foszfodiészteráz VI, COMT, GABA transzamináz és tirozin transzporterei hidroxiláz. A modafinil nem gátolja a MAO-B vagy a II-IV foszfodiészterázok aktivitását.
A modafinil által kiváltott ébrenlét a ± 1-adrenerg receptor antagonista, a prazosin által csökkenthető; azonban a modafinil inaktív más in vitro vizsgálati rendszerekben, amelyekről ismert, hogy reagálnak a ± ± adrenerg agonistákra, például a patkányok vas deferens készítményére.
Az armodafinil nem közvetlen vagy közvetett hatású dopamin receptor agonista. In vitro azonban mind az armodafinil, mind a modafinil kötődik a dopamin transzporterhez és gátolja a dopamin újrafelvételét. A modafinil esetében ez az aktivitás in vivo társult az extracelluláris dopaminszintek növekedésével az állatok egyes agyi régióiban. Géntechnológiával módosított egerekben, amelyekben nem volt dopamin transzporter (DAT), a modafinilnek hiányzott az ébredést elősegítő aktivitása, ami arra utal, hogy ez a tevékenység DAT-függő. Ugyanakkor a modafinil ébredést elősegítő hatásait - ellentétben az amfetamin hatásával - patkányokban a dopamin receptor antagonista haloperidol nem gátolta.
Ezenkívül az alfa-metil-p-tirozin, a dopaminszintézis-gátló, blokkolja az amfetamin hatását, de nem blokkolja a modafinil által kiváltott mozgásszervi aktivitást.
Az armodafinil és a modafinil ébredést elősegítő hatással rendelkezik, hasonlóan a szimpatomimetikumokhoz, beleértve az amfetaminot és metilfenidát, bár ezek farmakológiai profilja nem azonos a szimpatomimetikumokéval aminok. Az ébrenlét elősegítő hatásain és az állatok mozgásszervi aktivitását növelő képességén kívül a modafinil termel pszichoaktív és eufórikus hatások, hangulat, észlelés, gondolkodás és érzések változásai, amelyek jellemzőek az egyéb központi idegrendszeri stimulánsokra az emberekben. A modafinilnek erősítő tulajdonságai vannak, amint azt a majmokon történő önbeadása is korábban kiképezte, hogy a kokaint önműködően beadják; A modafinilt stimuláns-szerűként is részben megkülönböztették.
Nem-klinikai vizsgálatok alapján úgy tűnik, hogy a modafinil vagy az armodafinil két fő metabolitja, a sav és a szulfon, nem járul hozzá az alapvegyületek központi idegrendszert aktiváló tulajdonságaihoz.
farmakokinetikája
A NUVIGIL aktív alkotóeleme az armodafinil, amely a modafinil hosszabb élettartamú enantiomerje. A NUVIGIL lineáris időfüggetlen kinetikát mutat egyszeri és többszörös orális adagolás után. A szisztémás expozíció növekedése arányos az 50–400 mg dózistartományban. A 12 hetes adagolás során az időfüggő kinetika változását nem figyelték meg. A NUVIGIL látszólagos egyensúlyi állapotát az adagolást követő 7 napon belül sikerült elérni. Egyensúlyi állapotban a NUVIGIL szisztémás expozíciója az egyszeri adag után megfigyelt expozíció 1,8-szorosa. A tiszta R-enantiomer koncentráció-idő profiljai 50 mg NUVIGIL vagy 100 mg PROVIGIL beadását követően® (modafinil) szinte egymásra helyezhető.
Abszorpció
Orális alkalmazás után a NUVIGIL könnyen felszívódik. Az abszolút orális biohasznosulást az armodafinil vizes oldhatatlansága miatt nem határozták meg, amely kizárta az intravénás alkalmazást. A plazma csúcskoncentráció éhgyomri állapotban körülbelül 2 óra múlva alakul ki. Az élelmiszernek a NUVIGIL teljes biohasznosulására gyakorolt hatása minimálisnak tekinthető; azonban a csúcskoncentráció elérésének ideje (tmax) táplált állapotban körülbelül 2-4 órával késleltethető. Mivel a tmax a későbbiekben megnövekedett plazmaszinttel jár, az étel potenciálisan befolyásolhatja a NUVIGIL farmakológiai hatásának kezdetét és időtartamát.
terjesztés
A NUVIGIL látszólagos megoszlási térfogata megközelítőleg 42 liter. Az armodafinil fehérjéhez való kötődésre vonatkozó adatok nem állnak rendelkezésre. A modafinil azonban közepesen kötődik a plazmafehérjéhez (körülbelül 60%), főként az albuminnal. A NUVIGIL és az erősen fehérjehez kötött gyógyszerek kölcsönhatásának potenciálját minimálisnak tekintik.
Anyagcsere
In vitro és in vivo adatok azt mutatják, hogy az armodafinil hidrolitikus deamidáción, S-oxidáción és aromás gyűrű hidroxiláción megy keresztül, ezt követően a hidroxilált termékek glükuronid-konjugációja révén. Az amid-hidrolízis az egyetlen legszembetűnőbb anyagcsere-útvonal, ahol a szulfonképződés a citokróm P450 (CYP) 3A4 / 5 általi következő fontossággal bír. A többi oxidatív termék in vitro túl lassan képződik, hogy lehetővé váljon a felelős enzim (ek) azonosítása. Csak két metabolit éri el a plazmában észlelhető koncentrációkat (azaz az R-modafinilsav és a modafinilszulfon).
A NUVIGIL disztribúciójára vonatkozó adatok nem állnak rendelkezésre. A modafinil azonban elsősorban a metabolizmus útján ürül ki, túlnyomórészt a májban, és az alapvegyület kevesebb, mint 10% -a ürül a vizelettel. A beadott radioaktivitás összesen 81% -át fedezték fel a dózis beadását követő 11 napon belül, túlnyomórészt a vizeletben (80% vs. 1,0% a székletben).
kiküszöböléséről
A NUVIGIL szájon át történő beadása után az armodafinil látszólag monoexponenciális csökkenést mutat a plazma csúcskoncentrációhoz képest. A látszólagos terminális t ½ körülbelül 15 óra. A NUVIGIL szájon át történő clearance körülbelül 33 ml / perc.
Kábítószer-gyógyszer kölcsönhatások
Az armodafinil metabolizmusában számos út létezik, valamint az a tény, hogy egy nem a CYP-hez kapcsolódó út a leggyorsabb az armodafinil metabolizmusában, arra utalnak, hogy az NUVIGIL általános farmakokinetikai profiljára gyakorolt lényeges hatások valószínűsége alacsony az egyidejű CYP-gátlás miatt gyógyszereket.
In vitro adatok azt mutatták, hogy az armodafinil gyenge induktív választ mutat a CYP1A2 és esetleg a CYP3A ellen a koncentrációfüggő aktivitást, és hogy a CYP2C19 aktivitást visszafordíthatóan gátolja armodafinilt. Úgy tűnik, hogy az armodafinil más CYP-tevékenységeket nem befolyásolja. Egy in vitro vizsgálat kimutatta, hogy az armodafinil a P-glikoprotein szubsztrátja.
A NUVIGIL krónikus adagolása 250 mg-mal 32% -kal és 17% -kal csökkentette a midazolám szisztémás expozícióját egyszeri orális adagolás után (5). mg) és intravénás (2 mg) dózisok, ami arra utal, hogy a NUVIGIL alkalmazása mérsékelten indukálja a CYP3A-t tevékenység. Azoknak a gyógyszereknek, amelyek a CYP3A4 / 5 szubsztrátjai, mint például a ciklosporin, szükség lehet az adag módosítására. (Lát óvintézkedések, Gyógyszerkölcsönhatások).
A NUVIGIL krónikus adagolása 250 mg-ban nem befolyásolta a 200 mg koffein, a CYP1A2 aktivitás szubsztrátjának farmakokinetikáját.
A NUVIGIL egyetlen 400 mg-os adagjának és 40 mg omeprazolnak egyidejű alkalmazása fokozta a szisztémás szintet az omeprazol expozíciója körülbelül 40% -kal, ami azt jelzi, hogy az armodafinil mérsékelten gátolja a CYP2C19-et tevékenység. Azok a gyógyszerek, amelyek a CYP2C19 szubsztrátjai, szükség lehet az adag csökkentésére. (Lát óvintézkedések, Gyógyszerkölcsönhatások).
Nemi hatás
A populáció farmakokinetikai elemzése nem befolyásolja a nemek közötti hatást az armodafinil farmakokinetikájára.
Különleges populációk
A speciális populációkban az armodafinilre specifikus adatok nem állnak rendelkezésre.
Korhatás: A modafinil orális clearance-e (CL / F) enyhe (~ 20%) csökkenését figyelték meg egy adaggal végzett vizsgálatban 200 mg-os 12 alanyok átlagéletkora 63 év (tartomány 53-72 év), de a változást klinikailag nem valószínűnek tartották jelentős. Egy többszörös adaggal végzett vizsgálatban (300 mg / nap) 12 betegnél, átlagos életkora 82 év (67 - 87 év) A plazma modafinilszintje megközelítőleg kétszeresére emelkedett a korábban megegyező fiatalabbnál kapott modafinilszintnél alanyok. A többszörös egyidejű gyógyszerkészítmények lehetséges hatásai miatt, amelyekkel a betegek nagy része volt kezelve a modafinil farmakokinetikájában a látszólagos különbség nem tulajdonítható kizárólag a öregedés. Az eredmények azonban arra engednek következtetni, hogy az idős emberekben csökkent lehet a modafinil clearance-e (lásd Adagolás és adminisztráció).
Versenyhatás: A fajnak a modafinil farmakokinetikájára gyakorolt hatását nem vizsgálták.
Vesekárosodás: A 200 mg-os egyszeri adagú modafinil-vizsgálatban a súlyos krónikus veseelégtelenség (kreatinin-clearance ≤ 20 ml / perc) nem szignifikánsan befolyásolja a modafinil farmakokinetikáját, de a modafinilsav expozíciója 9-szeresére nőtt (lásd óvintézkedések).
Májkárosodás: A modafinil farmakokinetikáját és metabolizmusát májcirrózisban szenvedő betegekben (6 férfi és 3 nő) vizsgálták. Három betegnek volt B vagy B + cirrhosis, 6 betegnek pedig C vagy C + cirrhosis (a Child-Pugh pontszám kritériuma szerint). Klinikailag 9 beteg közül 8 icterikus volt, és mindegyikben ascites volt. Ezekben a betegekben a modafinil orális clearance-e körülbelül 60% -kal csökkent, és az egyensúlyi koncentráció megduplázódott a normál betegekhez képest. Súlyos májkárosodásban szenvedő betegek esetén a NUVIGIL adagját csökkenteni kell (lásd a 4.2 óvintézkedések és Adagolás és adminisztráció).
felső
Klinikai vizsgálatok
A NUVIGIL hatékonyságát az ébrenlét javításában a következő alváskor állapították meg rendellenességek: obstruktív alvási apnoe / hypopnea szindróma (OSAHS), narkolepszia és műszakos munka alvási rendellenességek (SWSD).
A statisztikai szignifikancia eléréséhez minden klinikai vizsgálathoz ´0,05 p-értékre volt szükség.
Obstruktív alvási apnoe / hypopnea szindróma (OSAHS)
A NUVIGIL hatékonyságát az OSAHS - hez kapcsolódó túlzott álmosságú betegek ébrenlétének javításában a két 12 hetes, többcentrikus, placebo-kontrollos, párhuzamos csoportos, kettős vak vizsgálat a járóbetegekkel, akik megfeleltek a Nemzetközi Alvászavarok osztályozási (ICSD) kritériumai az OSAHS vonatkozásában (amelyek összhangban állnak az American Psychiatric Association-rel is) DSM-IV kritériumok). Ezek a kritériumok magukban foglalják az alábbiakat: 1) a túlzott álmosság vagy álmatlanság, valamint a károsodás gyakori epizódjai légzés alvás közben, és a kapcsolódó funkciók, például hangos horkolás, reggeli fejfájás vagy szájszárazság ébredés; vagy 2) túlzott álmosság vagy álmatlanság; és poliszomnográfia, amely bemutatja az alábbiak egyikét: Több mint öt obstruktív apnea, amelyek mindegyikének időtartama meghaladja a 10 másodpercet, alvás óránként; és az alábbiak közül egy vagy több: az alvásból származó gyakori ébredések, amelyek apnénákkal járnak, bradytachycardia vagy artériás oxigén-deszaturáció az apneákkal összefüggésben. Ezen túlmenően, a vizsgálatokba való belépéshez minden betegnél túlzott álmosságot kellett követelni, amint azt kimutatták 10-ös ponttal az Epworth álmosság skálán, a folyamatos pozitív légúti nyomással történő kezelés ellenére (CPAP). A CPAP használatának dokumentálására, valamint a CPAP használatának dokumentálására, bizonyítékra volt szükség, hogy a CPAP hatékonyan csökkenti az apnoe / hypopnea epizódjait.
A betegeknek meg kellett felelniük a CPAP-nak, amelyet úgy határoztak meg, hogy a CPAP felhasználása „4 óra / éjszaka az éjszaka 70% -án”. A CPAP használata a vizsgálat során folytatódott. Mindkét vizsgálatban a hatékonyság elsődleges mértéke 1) az alvás késése volt, amelyet az ébrenlét fenntartási tesztje (MWT) értékel. és 2) a beteg általános betegség-állapotának változása, amelyet a végső klinikai globális benyomás (CGI-C) alapján mérnek látogatás. A sikeres vizsgálathoz mindkét intézkedésnek statisztikailag szignifikáns javulást kellett mutatnia.
Az MWT méri az alvás elindulásának késleltetését (percekben). Meghosszabbított MWT-t végeztünk teszt-ülésekkel, 2 órás intervallumokkal 9:00 és 7:00 között. Az elsődleges elemzés az első négy teszt (9:00 és 3:00) közötti alvási késések átlaga volt. Minden vizsgálati ülésen a résztvevőket arra kérték, hogy próbálják ébren maradni rendkívüli intézkedések nélkül. Minden tesztet 30 perc elteltével fejeztünk be, ha nem történt alvás, vagy közvetlenül az alvás kezdete után. A CGI-C egy 7 pontos skála, amelynek központja a Nincs változás, és a Nagyon Rosszabbtól a Nagyon Sok továbbfejlesztettig terjed. Az értékelők nem kaptak konkrét útmutatást azokról a kritériumokról, amelyeket a betegek besorolásakor alkalmazni kellene.
Az első vizsgálatban összesen 395 OSAHS-ben szenvedő beteget randomizáltak napi 150 mg NUVIGIL, 250 mg NUVIGIL vagy megfelelő placebo kezelésre. A NUVIGIL-mel kezelt betegek statisztikailag szignifikáns javulást mutattak az ébren maradásban, összehasonlítva a placebo-kezelt betegekkel, a végső látogatás során az MWT-vel mérve. A NUVIGIL-mel kezelt betegek statisztikailag szignifikánsan nagyobb száma javult az általános klinikai állapotban, a CGI-C skála alapján a végső látogatás során. A vizsgálatok kiindulási állapotában a MWT-ban mért átlagos alvási késések (percekben) az alábbi 1. táblázatban találhatók, a végső látogatás során a MWT-n belüli átlagos változással együtt. Azoknak a betegeknek a százalékos arányát, akiknél a klinikai vizsgálatokban valamilyen mértékben javultak a CGI-C, az alábbi 2. táblázatban mutatjuk be. A NUVIGIL két adagja hasonló nagyságrendű statisztikailag szignifikáns hatást váltott ki az MWT-re és a CGI-C-re is.
A második vizsgálatban 263 OSAHS-ben szenvedő beteget randomizáltak napi 150 mg NUVIGIL vagy placebo csoportba. A NUVIGIL-mel kezelt betegek statisztikailag szignifikáns javulást mutattak az ébren maradásban, összehasonlítva a placebóval kezelt betegekkel, az MWT-val mérve [1. táblázat]. A NUVIGIL-mel kezelt betegek statisztikailag szignifikánsan nagyobb száma javult az általános klinikai állapotban, a CGI-C skála alapján meghatározva [2. táblázat].
A NUVIGIL alkalmazása egyik vizsgálatban sem befolyásolta a polysomnográfiával mért éjszakai alvást.
narkolepszia
Megállapítottuk a NUVIGIL hatékonyságát az ébrenlét javításában a narkolepszia okozta túlzott álmosság (ES) esetén. egy 12 hetes, többcentrikus, placebo-kontrollos, párhuzamos csoportos, kettős vak vizsgálatban azon járóbetegek esetében, akik teljesítették az ICSD kritériumait narkolepszia. Összesen 196 beteget randomizáltak a NUVIGIL 150 vagy 250 mg / nap vagy megfelelő placebó kezelésére. A narkolepsziára vonatkozó ICSD-kritériumok magukban foglalják: 1) ismétlődő nappali napsütötteket vagy alvásba eső eseményeket, amelyek szinte naponta előfordulnak legalább három hónapok, plusz a posturalis izomtónus hirtelen bilaterális elvesztése intenzív érzelmekkel összefüggésben (kataplexia), vagy 2) túlzott panasz álmosság vagy hirtelen izomgyengeség a kapcsolódó jellemzőkkel: alvásbénulás, hypnagogikus hallucinációk, automatikus viselkedés, zavart súlyos alvási epizód; és poliszomnográfia, amely bemutatja az alábbiak egyikét: 10 percnél rövidebb alvásidő vagy 20 percnél rövidebb alvásidő (REM), és többszörös alvás Latencia teszt (MSLT), amely kimutatja az 5 percnél rövidebb átlagos alvási késleltetést és két vagy több alvásos REM periódust, és nincs orvosi vagy mentális rendellenesség a tünetek. A vizsgálatokba való belépéshez minden betegnél objektíven dokumentálni kellett a túlzott nappali álmosságot az MSLT segítségével 6 perc vagy annál rövidebb alvási késéssel, és nincs egyéb klinikailag jelentős aktív orvosi vagy pszichiátriai beteg rendellenesség. Az MSLT, a beteg elalvási képességének objektív poliszomográfiai értékelése nem stimuláló környezet, az alvás kezdetén mért késleltetés (percben megadva), átlagolva 4 tesztmenet alatt, 2 órás időközönként. A vizsgálati alanyoknak minden egyes vizsgálati ülés alkalmával csendesen feküdni és megpróbálni aludni. Minden tesztet 20 perc elteltével fejeztünk be, ha nem történt alvás, vagy közvetlenül az alvás kezdete után.
A hatékonyság elsődleges mérőszámai: 1) alvásidő, az ébrenlét fenntartásának tesztjével (MWT) értékelve, és 2) a beteg általános betegségének változása státusza a változás klinikai globális benyomásával (CGI-C) mérve az utolsó látogatás során (ezek leírását lásd a fenti klinikai vizsgálatok, OSAHS szakaszban) intézkedések). Ebben a vizsgálatban minden MWT teszt 20 perc elteltével befejeződött, ha nem történt alvás, vagy közvetlenül az alvás kezdete után.
A NUVIGIL-mel kezelt betegek statisztikailag szignifikánsan jobb képességet mutatnak arra, hogy ébren maradjanak a MWT-nál minden dózisban, összehasonlítva a végső látogatás placebójával [1. táblázat]. A NUVIGIL-mel kezelt betegek statisztikailag szignifikánsan nagyobb száma az egyes adagok esetén javította az általános klinikai állapotot, a CGI-C skála alapján a végső látogatás során [2. táblázat].
A NUVIGIL két adagja hasonló nagyságrendű statisztikailag szignifikáns hatást váltott ki a CGI-C-re. Bár az egyes adagok esetében statisztikailag szignifikáns hatást tapasztaltak a MWT-ra, a nagyobb adag esetében a hatás nagysága nagyobb volt.
A NUVIGIL használata nem befolyásolta a polysomnográfiával mért éjszakai alvást.
Munkahelyi alvási rendellenesség (SWSD)
A NUVIGIL hatékonysága az ébrenlét javításában olyan betegeknél, akiknél az alvázzal járó túlzott álmosság jelentkezik Az SWSD-t 12 hetes, többcentrikus, kettős vak, placebo-kontrollos, párhuzamos csoportban próba. Összesen 254 krónikus SWSD-s beteget randomizáltak napi 150 mg NUVIGIL vagy placebo kezelésre. Valamennyi beteg teljesítette a krónikus SWSD ICSD-kritériumait [amelyek összhangban állnak az American Psychiatric Association DSM-IV kritériumaival a cirkadiás ritmusú alvászavarok esetén: „Shift Work Type”. Ezek a kritériumok az alábbiakat foglalják magukban: 1) vagy: a) a túlzott álmosság vagy álmatlanság elsődleges panasza, amely időlegesen összekapcsolódik egy olyan munkaidővel (általában éjszakai munka), amely a szokásos alvási szakaszban fordul elő, vagy b) a poliszomnográfia és az MSLT kimutatja a normál alvás-ébrenlési minta elvesztését (azaz zavart kronobiológiai ritmus); és 2) semmilyen más orvosi vagy mentális rendellenesség nem magyarázza a tüneteket, és 3) a tünetek nem felelnek meg a kritériumoknak minden más álmatlanságot vagy túlzott álmosságot okozó alvászavar esetén (pl. időzóna megváltozása [jet lag] szindróma).
Meg kell jegyezni, hogy nem minden álmosságos panaszú beteg, aki szintén műszakban dolgozik, nem felel meg a SWSD diagnózisának kritériumainak. A klinikai vizsgálatba csak azokat a betegeket vették fel, akik legalább 3 hónapig tünetek voltak.
A bevont betegeknek szintén havonta legalább 5 éjszakai műszakot kellett dolgozniuk, túlzottan aludtak a az éjszakai műszakok ideje (MSLT pontszám 6 perc), és a nappali álmatlanságot nappali polysomnogrammal dokumentálják (PSG).
A hatékonyság elsődleges mérőszámai: 1) az alvás késése volt, amelyet a többszörös alvásidő-teszttel (MSLT) értékeltek, amelyet szimulált éjszakai műszakban végeztek az utolsó látogatás, és 2) a beteg általános állapotának változása, amelyet a változás klinikai globális benyomásával (CGI-C) mértek az utolsó látogatás során. (Lát Klinikai vizsgálatok, Narkolepszia és az OSAHS fenti szakaszai ezen intézkedések leírására).
A NUVIGIL-mel kezelt betegek statisztikailag szignifikánsan meghosszabbították az alvási időt A kezdeti kezdet a placebóval kezelt betegekkel összehasonlítva, az éjszakai MSLT-vel mérve a végső látogatás során [táblázat 1]. A NUVIGIL-mel kezelt betegek statisztikailag szignifikánsan nagyobb száma azt mutatta, hogy javult az általános klinikai állapot, a CGI-C skála alapján a végső látogatás során [2. táblázat].
A NUVIGIL használata nem befolyásolta a polysomnográfiával mért nappali alvást.
| Rendellenesség | Intézkedés | Nuvigil 150 mg * |
Nuvigil 250 mg * |
Placebo | |||
* Jelentősen különbözik a placebótól az összes vizsgálatban (p <0,05) | |||||||
| kiindulási | változás az alapvonaltól |
kiindulási | változás az alapvonaltól |
kiindulási | Váltás a kiindulási |
||
| OSAHS I | MWT | 21.5 | 1.7 | 23.3 | 2.2 | 23.2 | -1.7 |
| OSAHS II | MWT | 23.7 | 2.3 | - | - | 23.3 | -1.3 |
| narkolepszia | MWT | 12.1 | 1.3 | 9.5 | 2.6 | 12.5 | -1.9 |
| SWSD | MSLT | 2.3 | 3.1 | - | - | 2.4 | 0.4 |
| Rendellenesség | Nuvigil 150 mg * |
Nuvigil 250 mg * |
Placebo |
* Jelentősen különbözik a placebótól az összes vizsgálatban (p <0,05) | |||
| OSAHS I | 71% | 74% | 37% |
| OSAHS II | 71% | - | 53% |
| narkolepszia | 69% | 73% | 33% |
| SWSD | 79% | - | 59% |
felső
Javallatok és felhasználás
A NUVIGIL javallatok javítja az ébrenlét fokozott álmosságban szenvedő betegek esetén, obstruktiv alvási apnoe / hypopnea szindróma, narkolepszia és műszakos munka alvási rendellenességek esetén.
Az OSAHS-ben a NUVIGIL a mögöttes obstrukció standard kezelése (ke) t kiegészíti. Ha a folyamatos pozitív légúti nyomás (CPAP) a betegek számára választott kezelés, akkor a NUVIGIL kezelés megkezdése előtt maximális erőfeszítést kell tenni a CPAP kezelésére megfelelő ideig. Ha a NUVIGIL-t a CPAP-val együtt alkalmazzák, akkor a CPAP-megfelelés ösztönzésére és időszakos értékelésére van szükség.
Minden esetben rendkívüli figyelmet kell fordítani a mögöttes alvási rendellenességek diagnosztizálására és kezelésére. Az orvosoknak tisztában kell lenniük azzal, hogy néhány betegnél egynél több alvási rendellenesség is előfordulhat, amely hozzájárul a túlzott álmossághoz.
A NUVIGIL hatékonyságát hosszú távú (12 hétnél hosszabb) alkalmazás esetén nem szisztematikusan értékelték placebo-kontrollos vizsgálatokban. Az orvosnak, aki úgy dönt, hogy hosszabb ideig felírja a NUVIGIL-et, rendszeresen újraértékelnie kell az egyes betegek hosszú távú hasznosságát.
felső
Ellenjavallatok
A NUVIGIL ellenjavallt azoknál a betegeknél, akiknek túlérzékeny a modafinil és az armodafinil, vagy annak inaktív összetevői.
felső
FIGYELMEZTETÉSEK
Súlyos kiütés, beleértve a Stevens-Johnson-szindrómát
A felnőttekben súlyos, kórházi kezelést igénylő kiütésről és a kezelés abbahagyásáról számoltak be a armodafinil, valamint felnőttekben és gyermekekben a modafinil, az S és R modafinil racém keveréke (az utóbbi armodafinil).
Az armodafinilt nem vizsgálták gyermekkori betegekben egyetlen körülmények között sem, és gyermekek számára nem engedélyezett semmilyen indikáció céljából történő alkalmazásra.
Armodafinil felnőttkori klinikai vizsgálatokban (0/1595) 0 súlyos bőrkiütésről nem számoltak be. A forgalomba hozatalt követő felnőtteknél azonban súlyos bőrkiütésről számoltak be. Mivel az armodafinil a racém modafinil R-izomerje, nem zárható ki az armodafinil-kezelésben részesülő gyermekkori súlyos kiütés hasonló kockázata.
A modafinil (racemát) klinikai vizsgálatában a kezelés megszakítását eredményező kiütés gyakorisága körülbelül 0,8% (13/1585) volt gyermekkori betegeknél (életkor <17 év); ezek a kiütések egy esetleges Stevens-Johnson-szindróma (SJS) esetét és egy nyilvánvaló több szerv túlérzékenységi reakció esetét tartalmazták. Az esetek közül többet lázhoz és más rendellenességekhez (pl. Hányás, leukopénia) társultak. A bőrkiütés medián ideje, amely a kezelés megszakítását eredményezte, 13 nap volt. Nem észleltek ilyen esetet 380 placeboval kezelt gyermekgyógyászati beteg között. Felnőttkori klinikai vizsgálatokban (0/4 264) a modafinil súlyos bőrkiütésről nem számoltak be. Ritka esetekben súlyos vagy életveszélyes kiütések, beleértve az SJS-t, a toxikus epidermális nekrolízist (TEN) és a gyógyszeres kiütést Eozinofíliáról és szisztémás tünetekről (DRESS) számoltak be felnőttekben és gyermekekben, a világon a forgalomba hozatalt követően a modafinil-rel. A modafinil-használathoz kapcsolódó TEN és SJS jelentési aránya, amelyet általában elhanyagolhatónak tartanak az aluljelentés miatt, meghaladja a háttér előfordulási arányát. A súlyos bőrreakciók hátterének előfordulási arányának becslése az általános népességben 1-2 eset / millió személy évben.
Nincs olyan tényező, amelyről ismert, hogy megjósolja az armodafinil vagy a modafinil alkalmazásával járó kiütés kockázatát vagy súlyosságát. Az armodafinilhez vagy a modafinilhez kapcsolódó súlyos bőrkiütés szinte minden esetben a kezelés megkezdését követő 1-5 héten fordult elő. Ugyanakkor egyes esetekről számoltak be a modafinil-kezelés hosszabb ideig tartó (például 3 hónap) kezelése után. Ennek megfelelően a kezelés időtartama nem hivatkozhat arra, hogy megjósolja a kiütés első megjelenése által előidézett potenciális kockázatot.
Bár jóindulatú kiütések is előfordulnak az armodafinil esetében, nem lehet megbízhatóan megjósolni, hogy melyik kiütés bizonyul súlyosnak. Ennek megfelelően az armodafinilt általában a kiütés első jeleinél abba kell hagyni, kivéve, ha a kiütés egyértelműen nem függ össze a gyógyszerrel. A kezelés abbahagyása nem akadályozhatja meg, hogy a kiütés életveszélyessé váljon, vagy véglegesen megváltoztassa vagy eltorzuljon.
Angioödéma és anafilaktoid reakciók
Egy súlyos angioödéma és egy túlérzékenységi esetet (kiütés, dysphagia és bronchospasmus) észleltek 1595 armodafinil-kezelésben részesült beteg között. A betegeket figyelmeztetni kell a kezelés abbahagyására és az esetleges tünetekről azonnal értesíteni kell orvosát vagy angioödémát vagy anafilaxiát sugalló tünetek (például arc, szem, ajkak, nyelv vagy nyelv duzzanata) gége; nyelési vagy légzési nehézségek; rekedtség).
Több szerv túlérzékenységi reakciók
Több szerv túlérzékenységi reakciókkal, köztük legalább egy halállal a forgalomba hozatal utáni tapasztalatok során, van szoros időbeli összefüggésben (a detektáláshoz szükséges medián idő 13 nap: 4-33 tartomány) fordult elő a modafinil. Az armodafinil esetében a több szerv túlérzékenységi reakcióinak hasonló kockázata nem zárható ki.
Noha korlátozott számú jelentés készült, a több szerv túlérzékenységi reakciói kórházi kezelést vagy életveszélyesek lehetnek. Nincs olyan tényező, amelyről ismert, hogy megjósolja a modafinilrel járó több szerv túlérzékenységi reakciók előfordulásának kockázatát vagy súlyosságát. Ennek a rendellenességnek a jelei és tünetei különféleek voltak; azonban a betegek jellemzően, bár nem kizárólag, lázban és kiütésben szenvednek, amely más szervrendszeri beavatkozáshoz kapcsolódik. Egyéb kapcsolódó manifesztációk közé tartozik a szívizomgyulladás, hepatitisz, májfunkciós teszt rendellenességek, hematológiai rendellenességek (például eozinofília, leukopénia, thrombocytopenia), viszketés és gyengeség. Mivel a több szerv túlérzékenysége változó az expressziójában, más szervrendszeri tünetek és jelek, amelyeket itt nem említenek, előfordulhatnak.
Több szerv túlérzékenységi reakció gyanúja esetén a NUVIGIL-kezelést abba kell hagyni. Noha nincs olyan bejelentés, amely jelezné a kereszt-érzékenységet más szindrómát okozó gyógyszerekkel, a több szerv túlérzékenységével járó gyógyszerekkel kapcsolatos tapasztalatok azt jelzik, hogy ez a lehetőség.
Tartós álmosság
A NUVIGIL-t szedő, rendellenes álmosságú betegeket figyelmeztetni kell arra, hogy ébrenlétük szintje nem normalizálódik. A túlzott álmosságú betegeket, ideértve a NUVIGIL-t is, gyakran újra kell értékelni álmosság fokát, és adott esetben azt tanácsoljuk, hogy kerülje a vezetést vagy bármilyen egyéb potenciálisan veszélyes anyagot tevékenység. Az orvosoknak tisztában kell lenniük azzal is, hogy a betegek nem ismeri fel az álmosságot vagy az álmosságot, amíg közvetlenül nem kérdezik az álmosságot vagy álmosságot bizonyos tevékenységek során.
Pszichiátriai tünetek
Pszichiátriai káros mellékhatásokról számoltak be a modafinillal kezelt betegek esetében. A modafinil és az armodafinil (NUVIGIL) nagyon szorosan összefüggenek. Ezért az armodafinil-rel kapcsolatos pszichiátriai tünetek előfordulási gyakorisága és típusa várhatóan hasonló lesz a modafinil-rel kapcsolatos ilyen események előfordulásához és típusához.
A forgalomba hozatalt követő, a modafinil használatával járó nemkívánatos események között szerepelnek mánia, téveszmék, hallucinációk, öngyilkossági gondolatok és agresszió, néhány esetben kórházi kezelést eredményezve. Számos, de nem minden betegnél volt korábbi pszichiátriai anamnézis. Egy egészséges férfi önkéntes referencia, paranoid téveszmék és halló hallucinációk elképzeléseit fejlesztette ki többszöri napi 600 mg-os modafinil adaggal és alvásmentességgel együtt. A drog abbahagyása után 36 órával nem volt pszichózis.
A NUVIGIL ellenőrzött vizsgálatban a szorongást, izgatottságot, idegességet és ingerlékenységet okozták a kezelés abbahagyása a NUVIGIL-kezelésben részesülő betegeknél gyakrabban, mint a placebónál (NUVIGIL 1,2% és placebo 0.3%). A NUVIGIL-kontrollos vizsgálatokban a depresszió a NUVIGIL-kezelésben részesülő betegekben a placebóhoz képest gyakrabban abbahagyta a kezelést (NUVIGIL 0,6% és a placebo 0,2%). Az öngyilkosság gondolatának két esetét figyelték meg a klinikai vizsgálatok során. Óvatosan kell eljárni, amikor a NUVIGIL-et olyan betegeknek adják, akiknek kórtörténetében pszichózis, depresszió vagy mánia áll fenn. Ha a NUVIGIL alkalmazásával párhuzamosan pszichiátriai tünetek alakulnak ki, mérlegelje a NUVIGIL abbahagyását.
felső
ÓVINTÉZKEDÉSEK
Alvászavarok diagnosztizálása
A NUVIGIL-t csak azokban a betegekben szabad alkalmazni, akik teljes mértékben megbecsülték a túlzott álmosságot, és akiknél a vagy a narkolepszia, az OSAHS és / vagy az SWSD diagnosztizálására az ICSD vagy a DSM diagnosztikai kritériumoknak megfelelően került sor (lásd a Klinikai vizsgálatok). Az ilyen értékelés általában teljes anamnézisből és fizikai vizsgálatból áll, és kiegészíthető laboratóriumi környezetben végzett teszteléssel. Egyes betegeknél egynél több alvási rendellenesség is hozzájárulhat a túlzott álmossághoz (például, hogy az OSAHS és az SWSD ugyanazon betegnél egybeesik).
CPAP alkalmazás OSAHS-ben szenvedő betegek esetén
Az OSAHS-ben a NUVIGIL a mögöttes obstrukció standard kezelése (ke) t kiegészíti. Ha a folyamatos pozitív légúti nyomás (CPAP) a betegek számára választott kezelés, akkor a NUVIGIL kezelés megkezdése előtt maximális erőfeszítést kell tenni a CPAP kezelésére megfelelő ideig. Ha a NUVIGIL-t a CPAP-val együtt alkalmazzák, akkor a CPAP-megfelelés ösztönzésére és időszakos értékelésére van szükség. Kismértékű tendencia figyelhető meg a CPAP-felhasználás csökkenésére az idő múlásával (a NUVIGIL-szel kezelt betegek átlagos csökkenése 18 perccel) és 6 perces csökkentés a placebóval kezelt betegeknél, az átlagos kiindulási felhasználáshoz képest 6,9 óra / éj) a NUVIGIL-ben vizsgálatokban.
Tábornok
Noha nem bizonyították, hogy a NUVIGIL működési zavarokat okoz, a központi idegrendszert befolyásoló bármely gyógyszer megváltoztathatja az ítéletet, a gondolkodást vagy a motoros képességeket. A betegeket figyelmeztetni kell egy autó vagy más veszélyes gép üzemeltetésére, amíg nem lesz meglehetősen biztos, hogy a NUVIGIL-kezelés nem fogja hátrányosan befolyásolni képességeiket az ilyen beavatkozásban tevékenységek.
Szív-és érrendszer
A NUVIGIL-t nem értékelték ki, vagy nem használták észrevehető mértékben azokban a betegekben, akiknek közelmúltban kórtörténetében miokardiális infarktus vagy instabil angina fordult elő, ezért az ilyen betegeket óvatosan kell kezelni.
A PROVIGIL klinikai vizsgálata során olyan tünetek és tünetek szerepelnek, mint mellkasi fájdalom, szívdobogás, légszomj és átmeneti ischaemiás tünetek. Három betegnél megfigyelték a T-hullám változását az EKG-n, a mitralis szelep prolapsával vagy a bal kamra miatt túltengés. A NUVIGIL tabletták használata nem javasolt olyan betegek esetén, akiknél kórtörténetében bal kamra hipertrófiája volt, vagy akiknél mitralis szelep prolapsisban szenvedő betegek, akiknél a mitralis szelep prolapsis szindrómája volt, amikor korábban központi idegrendszeri kezelést kaptak stimulánsok. A mitralis szelep prolapsis szindróma jelei között szerepel, de nem kizárólag, az ischaemiás EKG változások, mellkasi fájdalom vagy aritmia. Ha ezen tünetek bármelyike újból megjelenik, mérlegelje a szív értékelését.
A vérnyomás monitorozása rövid távú (¤ 3 hónap) kontrollos vizsgálatokban csak az alacsony szisztolés és diasztolés vérnyomás NUVIGIL-kezelésben részesülő betegekben a placebóhoz képest (1,2–4,3 mmHg a különféle kísérleti csoportok). A NUVIGIL-kezelésben részesülő betegek némileg nagyobb aránya (2,9%) volt a vérnyomáscsökkentő gyógyszerek új vagy fokozottabb alkalmazását igénylő betegek arányában, szemben a placebót kapó betegekkel (1,8%). A NUVIGIL-kezelésben részesülő betegeknél helyénvaló lehet a vérnyomás fokozott ellenőrzése.
Szteroid fogamzásgátlókat használó betegek
A szteroid fogamzásgátlók hatékonysága csökkenthet, ha NUVIGIL-rel együtt alkalmazzák, és a kezelés abbahagyását követő egy hónapon belül (lásd óvintézkedések, Gyógyszerkölcsönhatások). Alternatív vagy egyidejű fogamzásgátlási módszerek ajánlottak a NUVIGIL-mel kezelt betegek számára és a NUVIGIL-kezelés abbahagyását követő egy hónapon belül.
Ciklosporint használó betegek
A NUVIGIL-rel együtt történő alkalmazáskor a ciklosporin vérszintje csökkenthet óvintézkedések, Gyógyszerkölcsönhatások). Ezen gyógyszerek együttes használata esetén mérlegelni kell a keringő ciklosporin-koncentráció figyelését és a ciklosporin adagjának megfelelő beállítását.
Súlyos májelégtelenségben szenvedő betegek
Súlyos májkárosodásban, cirrhózissal vagy anélkül (lásd: Klinikai farmakológia), A NUVIGIL-t csökkentett adagban kell beadni (lásd Adagolás és adminisztráció).
Súlyos vesekárosodásban szenvedő betegek
Nincs elég információ az adagolás biztonságosságának és hatékonyságának meghatározásához súlyos vesekárosodásban szenvedő betegek esetében (Vesekárosodásban alkalmazott farmakokinetikáról lásd: Klinikai farmakológia).
Idős betegek
Idős betegekben az armodafinil és metabolitjainak eliminációja az öregedés következményeként csökkenhet. Ezért fontolóra kell venni az alacsonyabb dózisok alkalmazását ebben a populációban (lásd Klinikai farmakológia és Adagolás és adminisztráció).
Információ a betegek számára
Az orvosoknak azt tanácsolják, hogy tárgyalják a következő kérdéseket azokkal a betegekkel, akiknek a NUVIGIL-t felírták.
A NUVIGIL javallt kóros álmosságú betegek számára. Bebizonyosodott, hogy a NUVIGIL javítja, de nem szünteti meg ezt az abnormális elalvási hajlamot. Ezért a betegeknek nem szabad megváltoztatniuk korábbi viselkedésüket potenciálisan veszélyes tevékenységek (pl. Vezetés, gépek kezelése) vagy más vonatkozásában olyan tevékenységek, amelyek megkövetelik az ébrenlét megfelelő szintjét, mindaddig, amíg és hacsak a NUVIGIL-kezelés nem bizonyítja, hogy ébrenlét olyan szintű, amely lehetővé teszi tevékenységek. A betegeket tájékoztatni kell arról, hogy a NUVIGIL nem helyettesíti az alvást.
A betegeket tájékoztatni kell arról, hogy kritikus jelentőségű lehet a korábban előírt kezeléseik folytatása (például a CPAP-t kapó OSAHS-ben szenvedő betegeknek ezt továbbra is folytatniuk kell).
A betegeket tájékoztatni kell a betegtájékoztató elérhetőségéről, és a NUVIGIL szedése előtt utasítani kell őket a betegtájékoztató elolvasására. A betegeknek adott betegtájékoztató szövegét lásd a betegtájékoztatásnak a címkézés végén.
A betegeket figyelmeztetni kell, hogy forduljanak orvoshoz, ha bőrkiütés, depresszió, szorongás vagy pszichózis vagy mánia jelei vannak.
Terhesség
A betegeket figyelmeztetni kell arra, hogy tájékoztassák orvosukat, ha terhes vagy terhességet tervez a kezelés alatt. A betegeket figyelmeztetni kell a terhesség esetleges megnövekedett kockázatára, amikor szteroid fogamzásgátlókat (beleértve a depót vagy beültethetőket) is alkalmaznak fogamzásgátlók) a NUVIGIL-szel és a kezelés abbahagyását követő egy hónapon belül (lásd Karcinogenezis, Mutagenezis, Termékenységi zavar és Terhesség).
Gondozás
A betegeket figyelmeztetni kell arra, hogy értesítsék orvosukat, ha csecsemőt szoptatnak.
Egyidejű gyógyszeres kezelés
A betegeket tájékoztatni kell arról, hogy tájékoztassák orvosukat, ha bármilyen szedést terveznek vagy terveznek vényköteles vagy vény nélkül kapható gyógyszerek, mivel a NUVIGIL és a egyéb gyógyszerek.
Alkohol
A betegeket figyelmeztetni kell arra, hogy a NUVIGIL alkohollal történő kombinációját nem vizsgálták. A betegeket figyelmeztetni kell arra, hogy az NUVIGIL szedésekor óvatos az alkohol elkerülése.
Allergiás reakciók
A betegeket tájékoztatni kell arról, hogy hagyja abba a NUVIGIL szedését, és értesítse orvosát, ha bőrkiütés jelentkezik, csalánkiütés, szájfekélyek, hólyagok, bőrhámlás, nyelési vagy légzési nehézségek vagy kapcsolódó allergiás tünetek jelenség.
Gyógyszerkölcsönhatások
Potenciális interakciók olyan gyógyszerekkel, amelyek gátolják, indukálják vagy metabolizálják a citokróm P450 izoenzimeket és más májbenzimeket
Mivel a CYP3A enzimek részben részt vesznek az armodafinil metabolikus eliminációjában, a CYP3A4 / 5 potenciális indukálóinak együttes adása (például karbamazepin, fenobarbitál, rifampin) vagy a CYP3A4 / 5 inhibitorok (például ketokonazol, eritromicin) megváltoztathatják a armodafinilt.
A NUVIGIL képessége arra, hogy enzim indukció vagy gátlás útján megváltoztassa más gyógyszerek metabolizmusát
A CYP1A2 által metabolizált gyógyszerek: In vitro adatok azt mutatták, hogy az armodafinil gyenge induktív választ mutat a CYP1A2 és esetleg a CYP3A ellen A koncentráció függvényében befolyásolja az aktivitást, és bebizonyította, hogy a CYP2C19 aktivitást visszafordíthatóan gátolja armodafinilt. A koffeinnel végzett interakciós vizsgálatban azonban a CYP1A2 aktivitásra gyakorolt hatást klinikailag nem figyelték meg (lásd: Klinikai farmakológia, Farmakokinetika, gyógyszer-gyógyszer kölcsönhatások).
CYP3A4 / 5 által metabolizált gyógyszerek (például ciklosporin, etinil-ösztradiol, midazolam és triazolám): A NUVIGIL krónikus adagolása a CYP3A aktivitás mérsékelt indukálását eredményezte. Ezért a gyógyszerek hatékonysága, amelyek szubsztrátot jelentenek a CYP3A enzimek számára (például ciklosporin, etinil) ösztradiol, midazolám és triazolám) csökkenthetik az egyidejű kezelés megkezdését követően NUVIGIL. Az orális midazolám szisztémás expozíciójának 32% -os csökkenését figyelték meg az armodafinil és a midazolám együttes alkalmazásakor. Szükség lehet az adag módosítására (lásd Klinikai farmakológia, Farmakokinetika, gyógyszer-gyógyszer kölcsönhatások). Ezeket a hatásokat (csökkentett koncentrációk) a modafinil ciklosporinnal, etinil-ösztradiollal és triazolámmal történő egyidejű alkalmazásakor is megfigyelték.
CYP2C19 által metabolizált gyógyszerek (például omeprazol, diazepam, fenitoin és propranolol): A NUVIGIL beadása a CYP2C19 aktivitás mérsékelt gátlását eredményezte. Ennélfogva egyes gyógyszereknél, amelyek a CYP2C19 szubsztrátjai (például fenitoin, diazepam és propranolol, omeprazol és klomipramin), a NUVIGIL-rel egyidejűleg történő alkalmazás esetén szükség lehet a dózis csökkentésére. Az expozíció 40% -kal növekedett az armodafinil és az omeprazol egyidejű alkalmazásakor. (Lát Klinikai farmakológia, Farmakokinetika, gyógyszer-gyógyszer kölcsönhatások).
Kölcsönhatások a központi idegrendszerrel AGyógyszerek
Az armodafinil gyógyszer-gyógyszer kölcsönhatás potenciáljáról a központi idegrendszer aktív gyógyszerekkel kapcsolatos adatok nem állnak rendelkezésre. Ugyanakkor a következő, a gyógyszerek és a gyógyszerek kölcsönhatásáról szóló, a modafinilről szóló információknak alkalmazandóknak kell lenniük az armodafinilre (lásd: Leírás és Klinikai farmakológia).
A modafinil metilfenidáttal vagy dextroamfetaminnal történő egyidejű alkalmazása nem okozott szignifikáns változást a a modafinil vagy bármely stimuláns farmakokinetikai profilja, annak ellenére, hogy a modafinil felszívódása kb. óra.
Az egyidejű modafinil vagy a klomipramin nem változtatta meg egyik gyógyszer PK-profilját sem; a modafinil-kezelés alatt azonban narkolepsziában szenvedő betegekben a klomipramin és annak aktív metabolitja, a dezmetil-klomipramin megemelkedett eseményéről számoltak be.
Armodafinil vagy modafinil gyógyszer-gyógyszerkölcsönhatásokkal szemben a monoamin-oxidáz (MAO) gátlókkal kapcsolatos potenciális adatok nem állnak rendelkezésre. Ezért körültekintően kell eljárni a MAO-gátlók és a NUVIGIL egyidejű alkalmazásakor.
Kölcsönhatások más gyógyszerekkel
További armodafinil gyógyszer-gyógyszerkölcsönhatásokkal kapcsolatos további adatok nem állnak rendelkezésre. Azonban a modafinilről a következő, a drogokkal kapcsolatos interakciókra vonatkozó információt alkalmazni kell az armodafinilre.
warfarin - A modafinil és a warfarin egyidejű alkalmazása nem okozott szignifikáns változást az R- és S-warfarin farmakokinetikai profiljában. Mivel azonban ebben a tanulmányban csak egyetlen warfarin adagot vizsgáltak meg, a farmakodinámiás kölcsönhatás nem zárható ki. Ezért fontolóra kell venni a protrombin-idő / INR gyakoribb ellenőrzését, amikor a NUVIGIL-et warfarinnal együtt adják.
Karcinogenezis, mutagenezis, termékenység romlása
Karcinogenezis
Karcinogenitási vizsgálatokat nem végeztek önmagában az armodafinillal. Karcinogenitási vizsgálatokat végeztek, amelyek során a modafinilt az étrendben adták be egereknek 78 hétig és patkányoknak 104 héten át, napi 6, 30 és 60 mg / kg dózisban. A vizsgált legmagasabb dózis 1,5 (egér) vagy 3 (patkány) alkalommal nagyobb, mint a felnőtt embernek javasolt napi dózisa (200 mg), mg / m2 alapon. Ezekben a vizsgálatokban nem találtak bizonyítékot a modafinil alkalmazásával járó tumorigenezisre. Mivel azonban az egérvizsgálat nem megfelelő nagy adagot alkalmazott, amely nem reprezentálta a maximális tolerálható adagot, egy későbbi karcinogenitási vizsgálatot végeztek a Tg-ben. AC transzgenikus egér. A Tg-ben értékelt dózisok Az AC-vizsgálat 125, 250 és 500 mg / kg / nap volt, dermálisan adva. A modafinil alkalmazásával kapcsolatban nem volt bizonyított tumorigenitás; ez a dermális modell azonban nem képes megfelelően értékelni az orálisan beadott gyógyszer karcinogenitási képességét.
mutagenezis
Az armodafinilt in vitro bakteriális reverz mutációs vizsgálattal és in vitro emlősök kromoszóma-rendellenesség-vizsgálatával vizsgálták humán limfocitákban. Az armodafinil negatív volt ezekben a vizsgálatokban, mind metabolikus aktiválás hiányában, mind jelenlétében.
A modafinil in vitro sorozatban (azaz bakteriális reverz mutációs vizsgálat, egér lymphoma tk assay, kromoszóma-aberráció) nem mutatott mutagén vagy klastogén potenciált. vizsgálat humán limfocitákban, sejt transzformációs vizsgálat BALB / 3T3 egér embriósejtekben) vizsgálatok metabolikus aktiváció hiányában vagy hiányában, vagy in vivo (egér csontvelő mikronukleusz) vizsgálatokban. A modafinil szintén negatív volt a nem tervezett DNS szintézis vizsgálatban patkány májsejtekben.
A termékenység romlása
Termékenységi és korai embrionális fejlődés (implantációig) vizsgálatot nem csak armodafinilrel végeztek.
A modafinil szájon át történő beadása (legfeljebb 480 mg / kg / nap dózis) hím és nőstény patkányok előtt és alatt a párzás, és a nőstényekben a terhesség 7. napján folytatódik, a legmagasabb a párzási idő meghosszabbodása dózis; más termékenységi vagy reproduktív paraméterekre nem figyeltek meg hatást. A hatás nélküli, 240 mg / kg / nap dózist a plazma modafinil expozícióval (AUC) hozzávetőlegesen megegyezik azzal, mint az embernél, ha a javasolt 200 mg-os adagot alkalmazzák.
Terhesség
C. terhességi kategória
Patkányokon (armodafinil, modafinil) és nyulakon (modafinil) végzett vizsgálatok során klinikai szempontból releváns expozíciók esetén megfigyelték a fejlődési toxicitást.
Az armodafinil orális beadása (60, 200 vagy 600 mg / kg / nap) vemhes patkányoknak az organogenezis időszakában az a magzati zsigeri és csontváz-ingadozások előfordulása közbenső vagy annál nagyobb adag esetén, és a magzati testtömeg legmagasabb csökkenése dózis. A patkányok embrionális és magzati fejlődési toxicitásának hatásmentes dózisát plazma armodafinil-rel társították az expozíció (AUC) körülbelül 0,03-szorosa az AUC-nek az embereknél a maximális ajánlott napi 250 adag esetén mg.
A modafinil (50, 100 vagy 200 mg / kg / nap) szájon át beadva terhes patkányoknak az egész organikusgenezis ideje alatt, kiváltva anyai toxicitás, az resorpciók növekedése, valamint az utódoknál a zsigeri és csontváz változások gyakoribb előfordulása dózis. A patkányok embrionális és magzati fejlődési toxicitása esetén a magasabb hatás nélküli dózist plazmával társították - a modafinil expozíció körülbelül az AUC 0,5 - szerese az embereknél az ajánlott napi dózis (RHD) mellett 200 mg. Egy későbbi, napi 480 mg / kg-os vizsgálatban (a plazma modafinil expozíciója körülbelül az AUC kétszerese az embereknél az RHD-nál) azonban nem figyeltünk meg káros hatást az embriofetális fejlődésre.
A modafinilt orálisan adták terhes nyulaknak az organogenezis teljes ideje alatt, legfeljebb 100 dózisban mg / kg / nap (a plazma modafinil AUC megközelítőleg megegyezik az emberek AUC-jével az RHD-nál) nem volt hatással az embriofetalis fejlesztés; az alkalmazott dózisok azonban túl alacsonyak voltak ahhoz, hogy a modafinil embriofetális fejlődésére gyakorolt hatásait megfelelően fel lehessen mérni. Egy későbbi fejlesztési toxicitási vizsgálatban 45, 90 és 180 mg / kg / nap dózisokat vizsgáltak terhes nők esetében A nyulak esetében a magzati szerkezeti változások és az embriofetális halál előfordulási gyakorisága a legmagasabb volt dózis. A fejlődési toxicitás szempontjából a legmagasabb hatás nélküli dózist egy plazma modafinil AUC-vel társították, amely megközelítőleg megegyezik az emberek AUC-jével az RHD-nál.
A modafinil beadása patkányoknak a terhesség és a szoptatás ideje alatt, akár napi 200 mg / kg orális dózisok esetén is csökkent életképesség az utódokban 20 mg / kg / nap-nál nagyobb dózisok mellett (a plazma modafinil AUC-je körülbelül 0,1-szerese az AUC-nek az embereknél a RHD). A túlélő utódoknál nem figyeltek meg hatást a postnatális fejlődési és neuro-viselkedési paraméterekre.
Terhes nőkön nincs megfelelő és jól ellenőrzött vizsgálat sem armodafinilről, sem a modafinilről. Két alkalommal számoltak be a méhen belüli növekedés retardációról és egy spontán abortuszról az armodafinil és a modafinil kezelés kapcsán. Bár az armodafinil farmakológiája nem azonos a szimpatomimetikus aminok farmakológiájával, ennek ugyanakkor bizonyos farmakológiai tulajdonságai vannak. Ezeknek a gyógyszereknek bizonyos részeit intrauterin növekedési retardációval és spontán abortuszokkal társították. Nem ismeretes, hogy az armodafinil-rel kapcsolatban jelentett esetek kábítószerrel kapcsolatosak-e.
Az armodafinilt vagy a modafinilt terhesség alatt csak akkor szabad alkalmazni, ha a lehetséges előny igazolja a magzatra gyakorolt potenciális kockázatot.
Munka és szállítás
Az armodafinil humán szülésre és szülésre gyakorolt hatását nem szisztematikusan vizsgálták.
Szoptató anyák
Nem ismert, hogy az armodafinil vagy metabolitjai kiválasztódnak-e az anyatejbe. Mivel sok gyógyszer kiválasztódik az anyatejbe, ezért a NUVIGIL tablettát szoptató nőnek kell adni.
Gyermekgyógyászati alkalmazás
Az armodafinil biztonságosságát és hatékonyságát 17 év alatti egyéneknél nem igazolták. Súlyos kiütést tapasztaltak a modafinilt kapó gyermekkori betegeknél
Geratric használat
A biztonságot és a hatékonyságot 65 év feletti egyéneknél nem igazolták.
felső
Mellékhatások
Az armodafinil biztonságosságát több mint 1100 olyan betegnél vizsgálták, akiknél túlzott álmosság jelentkezik, elsődleges alvászavarok és ébrenlét miatt. A klinikai vizsgálatok során a NUVIGIL-t általában jól tolerálták, és a legtöbb káros tapasztalat enyhe vagy közepes volt.
A placebo-kontrollos klinikai vizsgálatokban a felhasználással kapcsolatos leggyakrabban megfigyelt mellékhatások (5%) és a placebóval kezelt betegeknél gyakrabban előforduló fejfájás, émelygés, szédülés és álmatlanság. A mellékhatások profilja hasonló volt a vizsgálatok során.
A placebo-kontrollos klinikai vizsgálatokban a NUVIGIL-t kapó 645 beteg közül 44 (7%) abbahagyta a mellékhatások miatt, szemben a placebót kapó 445 betegből (4%). A abbahagyás leggyakoribb oka a fejfájás (1%).
Előfordulás az ellenőrzött vizsgálatokban
Az alábbi táblázat (3. táblázat) azokat a káros tapasztalatokat mutatja be, amelyek legalább 1% -os arányban fordultak elő, és még több volt gyakori a NUVIGIL-szel kezelt betegeknél, mint a placebo-csoport betegeinél a placebo-kontrollos klinikai vizsgálatokban.
Az orvosnak tisztában kell lennie azzal, hogy az alábbiakban megadott számadatok nem használhatók fel a káros tapasztalatok gyakoriságának előrejelzésére a szokásos orvosi gyakorlat, ahol a beteg jellemzői és más tényezők eltérhetnek a klinikai kezelés során bekövetkezőktől tanulmányok. Hasonlóképpen, az idézett gyakoriságot nem lehet közvetlenül összehasonlítani más klinikai vizsgálatokból származó adatokkal, amelyek különböző kezeléseket, felhasználásokat vagy kutatókat tartalmaznak. Ezeknek a gyakoriságoknak a felülvizsgálata azonban alapot ad az orvosoknak arra, hogy felbecsüljék a gyógyszerészeti és nem gyógyszerészeti tényezők relatív hozzájárulását a vizsgált populációban a káros események előfordulásához.
| Orgonarendszer A MedDRA preferált kifejezése |
Nuvigil (Százalék, N = 645) |
Placebo (Százalék, N = 445) |
ª Négy kettős-vak, placebo-kontrollos klinikai vizsgálat SWSD, OSAHS és narkolepszia esetében; az incidenciát a legközelebbi teljes százalékra kerekítik. Ide tartoznak csak azok az események, amelyeknél a Nuvigil gyakorisága meghaladja a placeboét. | ||
| Szívbetegségek | ||
| Palpitáció | 2 | 1 |
| Emésztőrendszeri rendellenességek | ||
| Hányinger | 7 | 3 |
| Hasmenés | 4 | 2 |
| Száraz száj | 4 | 1 |
| diszpepszia | 2 | 0 |
| Hasi fájdalom felső | 2 | 1 |
| Székrekedés | 1 | 0 |
| Hányás | 1 | 0 |
| Laza széklet | 1 | 0 |
| Általános rendellenességek és az adminisztráció helyének feltételei | ||
| Fáradtság | 2 | 1 |
| Szomjúság | 1 | 0 |
| Influenza-szerű betegség | 1 | 0 |
| Fájdalom | 1 | 0 |
| láz | 1 | 0 |
| Immunrendszeri rendellenességek | ||
| Szezonális allergia | 1 | 0 |
| Laboratóriumi vizsgálatok eredményei | ||
| Emelkedett a gamma-glutamil-transzferáz | 1 | 0 |
| Növekedett pulzusszám | 1 | 0 |
| Anyagcsere és táplálkozási rendellenességek | ||
| Étvágytalanság | 1 | 0 |
| Csökkent étvágy | 1 | 0 |
| Idegrendszeri rendellenességek | ||
| Fejfájás | 17 | 9 |
| Szédülés | 5 | 2 |
| Figyelem zavarása | 1 | 0 |
| Remegés | 1 | 0 |
| Migrén | 1 | 0 |
| Paraesthia | 1 | 0 |
| Pszichiátriai rendellenességek | ||
| Álmatlanság | 5 | 1 |
| Szorongás | 4 | 1 |
| Depresszió | 2 | 0 |
| Agitáció | 1 | 0 |
| Idegesség | 1 | 0 |
| Depressziós hangulat | 1 | 0 |
| Vese- és húgyúti rendellenességek | ||
| polyuria | 1 | 0 |
| Légzőrendszeri, mellkasi és mediastinalis rendellenességek | ||
| A nehézlégzés | 1 | 0 |
| Bőr- és szubkután szöveti rendellenességek | ||
| Kiütés | 2 | 0 |
| Lépjen kapcsolatba a bőrgyulladással | 1 | 0 |
| hyperhydrosis | 1 | 0 |
A káros események dózisfüggősége
A placebo-kontrollos klinikai vizsgálatokban, amelyekben a napi 150 mg és a Nuvigil 250 mg / nap adagját hasonlították össze a placebóval, az egyetlen dózisfüggő mellékhatás a fejfájás, kiütés, depresszió, szájszárazság, álmatlanság és hányinger.
ª Négy kettős-vak, placebo-kontrollos klinikai vizsgálat SWSD-ben, OSAHS-ben és narkolepsziaban. | ||||
| Orgonarendszer A MedDRA preferált kifejezése |
Nuvigil 250 mg (Százalék, N = 198) |
Nuvigil 150 mg (Százalék, N = 447) |
Nuvigil Kombinált (Százalék, N = 645) |
Placebo (Százalék, N = 445) |
|---|---|---|---|---|
| Emésztőrendszeri rendellenességek | ||||
| Hányinger | 9 | 6 | 7 | 3 |
| Száraz száj | 7 | 2 | 4 | <1 |
| Idegrendszeri rendellenességek | ||||
| Fejfájás | 23 | 14 | 17 | 9 |
| Pszichiátriai rendellenességek | ||||
| Álmatlanság | 6 | 4 | 5 | 1 |
| Depresszió | 3 | 1 | 2 | <1 |
| Bőr- és szubkután szöveti rendellenességek | ||||
| Kiütés | 4 | 1 | 2 | <1 |
Életjel változások
Kontrollált vizsgálatokban kismértékben, de következetesen növekedtek az átlagos szisztolés és diasztolés vérnyomás átlagértékei (lásd: óvintézkedések). Kontrollált vizsgálatokban a pulzusszám kis, de következetes növekedése volt a placebóhoz képest. Ez a növekedés 0,9-ről 3,5 BPM-re változott.
Laboratóriumi változások
A vizsgálatok során megfigyelték a klinikai kémiát, a hematológiát és a vizeletvizsgálati paramétereket. A gamma-glutamil-transzferáz (GGT) és az alkalikus foszfatáz (AP) átlagos plazmaszintjei a NUVIGIL beadását követően magasabbak voltak, ám a placebót nem. Kevés személynél azonban a GGT vagy AP emelkedése a normál tartományon kívül esett. Nem mutattak különbséget az alanin-aminotranszferáz, az aszpartát-aminotranszferáz, az összes fehérje, albumin vagy teljes bilirubin, bár ritkán fordultak elő az AST és / vagy az ALAT emelkedése. Az enyhe pancytopenia egyetlen esetét megfigyelték a 35 napos kezelés után és a gyógyszer abbahagyásával megszűnt. A klinikai vizsgálatokban a szérum húgysav átlagos, a kiindulási értékhez viszonyított kis mértékű csökkenését tapasztalták a placebóhoz képest. Ennek a megállapításnak a klinikai jelentősége nem ismert.
EKG változások
A NUVIGIL beadásának placebo-kontrollos klinikai vizsgálatokban nem tulajdonítható az EKG rendellenességek mintázata.
felső
Kábítószer-visszaélés és függőség
Szabályozott anyag osztály
Az armodafinil (NUVIGIL) egy IV. Listán szereplő szabályozott anyag.
Visszaélés lehetősége és függősége
Noha az armodafinil visszaélési potenciálját nem külön vizsgálták, valószínűleg a visszaélés lehetősége hasonló a modafinilhez (PROVIGIL). Az emberekben a modafinil pszichoaktív és eufórikus hatásokat, valamint a többi központi idegrendszeri stimulánsokra jellemző hangulati, észlelési, gondolkodási és érzelmi változásokat idéz elő. In vitro kötődési vizsgálatokban a modafinil kötődik a dopamin újrafelvétel helyéhez és növeli az extracelluláris dopamint, de nem növeli a dopamin felszabadulását. A modafinil megerősödik, amint azt a saját maga általi beadása majmoknál, akiket korábban a kokain önálló beadására képeztek ki. Bizonyos tanulmányokban a modafinilt stimuláns-szerűként is részben megkülönböztették. Az orvosoknak szorosan nyomon kell követniük azokat a betegeket, különösen azokat, akiknek anamnézisében szerepelnek kábítószer és / vagy stimuláns (például metil-fenidát, amfetamin vagy kokain) visszaélések. A betegeket figyelni kell a visszaélés vagy visszaélés jeleire (például az adag növelése vagy a drogkereső magatartás).
A modafinil (200, 400 és 800 mg) bántalmazási potenciálját metilfenidáttal (45 és 90 mg) szemben vizsgálták egy visszaélésszerű gyógyszerekkel szenvedő egyénekben végzett, fekvőbeteg-vizsgálatban. A klinikai vizsgálat eredményei azt mutatták, hogy a modafinil pszichoaktív és eufórikus hatásokat és érzéseket vált ki más, tervezett központi idegrendszeri stimulánsokkal (metilfenidát) összhangban.
felső
Overdose
Emberi tapasztalat
A NUVIGIL klinikai vizsgálatokban nem jelentettek túladagolást. A NUVIGIL túladagolás tünetei valószínűleg hasonlóak a modafinil tüneteihez. A modafinil klinikai vizsgálatokban a túladagolás magában foglalta gerjesztést vagy izgatottságot, álmatlanságot, valamint a hemodinamikai paraméterek enyhe vagy közepes emelkedését. A forgalomba hozatalt követő, a modafinilrel kapcsolatos tapasztalatok alapján nem számoltak be halálos túladagolásokról, amelyek önmagukban a modafinil-t (legfeljebb 12 gramm dózisok) érintik. Több gyógyszer, köztük a modafinil túladagolása halálos kimenetelt eredményezett. A tünetek között szerepelnek a leggyakrabban a modafinil túladagolása, önmagában vagy más gyógyszerekkel kombinálva; álmatlanság; központi idegrendszeri tünetek, mint például nyugtalanság, zavart, zavart, gerjesztés és hallucináció; emésztőrendszeri változások, például émelygés és hasmenés; és kardiovaszkuláris változások, például tachikardia, bradycardia, magas vérnyomás és mellkasi fájdalom.
Túladagolás kezelése
A NUVIGIL túladagolás toxikus hatásaira nincs specifikus antidotum. Az ilyen túladagolást elsősorban szupportív kezeléssel kell kezelni, ideértve a kardiovaszkuláris monitorozást is. Ha nincs ellenjavallat, mérlegelni kell az indukált hányást vagy a gyomormosást. Nincs adat arra, hogy a dialízis, a vizelet savasodása vagy lúgosítása hasznos legyen a gyógyszer eliminációjának fokozásában. Az orvosnak mérlegelnie kell a mérgezés-ellenőrző központ felkeresését tanácsadásért a túladagolás kezelésével kapcsolatban.
felső
Adagolás és adminisztráció
Obstruktív alvási apnoe / hypopnea szindróma (OSAHS) és narkolepszia
A NUVIGIL ajánlott adagja OSAHS-ben vagy narkolepsziában szenvedő betegek esetén 150 mg vagy 250 mg, reggel egyszeri adagként. Az OSAHS-ben szenvedő betegeknél a napi 250 mg-os adagokat, egyetlen adagként adva, jól tolerálták, de nem egyértelmű bizonyíték arra, hogy ez az adag a napi 150 mg - os adagon túlmutat további előnyöket (lásd Klinikai farmakológia és Klinikai vizsgálatok).
Munkahelyi alvási rendellenesség (SWSD)
A NUVIGIL ajánlott adagja SWSD-s betegek esetén 150 mg naponta, kb. 1 órával a munkaváltás megkezdése előtt.
Az egyidejű, a CYP3A4 / 5 szubsztrátját szedő gyógyszerek, például a szteroid fogamzásgátlók, a triazolám és a ciklosporin adagjának módosítását mérlegelni kell (lásd ÓVINTÉZKEDÉSEK, Gyógyszerkölcsönhatások).
Azok a gyógyszerek, amelyek nagymértékben eliminálódnak a CYP2C19 metabolizmus révén, mint például a diazepam, a propranolol és a fenitoin a NUVIGIL-mel történő egyidejű alkalmazás esetén hosszan tartó elimináció, és szükség lehet az adag csökkentésére és a toxicitás ellenőrzésére (Lát óvintézkedések, Gyógyszerkölcsönhatások).
Súlyos májkárosodásban szenvedő betegeknél a NUVIGIL-t csökkentett adagban kell beadni (lásd: Klinikai farmakológia és óvintézkedések).
Nincs elég információ az adagolás biztonságosságának és hatékonyságának meghatározásához súlyos veseelégtelenségben szenvedő betegek esetében (lásd Klinikai farmakológia és óvintézkedések).
Idős betegekben az armodafinil és metabolitjainak eliminációja az öregedés következményeként csökkenhet. Ezért fontolóra kell venni az alacsonyabb dózisok alkalmazását ebben a populációban (lásd Klinikai farmakológia és óvintézkedések).
felső
Hogyan szállítják / tárolják és kezelik
Nuvigil® (armodafinil) tabletta [C-IV]
50 mg: Minden kerek, fehér vagy törtfehér tabletta felirattal van ellátva  az egyik oldalon és a "205" a másikon.
az egyik oldalon és a "205" a másikon.
NDC 63459-205-60 - 60-as palack
150 mg: Minden ovális, fehér vagy törtfehér tabletta felirattal van ellátva  az egyik oldalon és a "215" a másikon.
az egyik oldalon és a "215" a másikon.
NDC 63459-215-60 - 60-as palack
250 mg: Minden ovális, fehér vagy törtfehér tabletta felirattal van ellátva  az egyik oldalon és a "225" a másikon.
az egyik oldalon és a "225" a másikon.
NDC 63459-225-60 - 60-as palack
Tárolja 20 ° - 25 ° C-on (68 ° - 77 ° F).
Gyártva:
Cephalon, Inc.
Frazer, PA 19355
Utoljára frissítve: 02/2010
A Nuvigil betegtájékoztatója (egyszerűen angolul)
Részletes információ a Alvászavarok jelei, tünetei, okai, kezelése
Az ebben a monográfiában szereplő információknak nem célja az összes lehetséges felhasználás, utasítások, óvintézkedések, gyógyszerkölcsönhatások vagy káros hatások lefedése. Ez az információ általános, és nem célja speciális orvosi tanácsadás. Ha kérdése van a használt gyógyszerekkel kapcsolatban, vagy további információt szeretne, keresse fel orvosát, gyógyszerészét vagy ápolóját.
vissza a:
~ minden cikk az alvási rendellenességekről

