Janumet a cukorbetegség kezelésére
Márkanév: Janumet
Általános név: szitagliptin és metformin-hidroklorid
Tartalom:
Javallatok és felhasználás
Adagolás és adminisztráció
Adagolási formák és erősségek
Ellenjavallatok
Figyelmeztetések és óvintézkedések
Mellékhatások
Gyógyszerkölcsönhatások
Használat meghatározott populációkban
Overdose
Leírás
Gyógyszertan
Nem klinikai toxikológia
Klinikai vizsgálatok
Hogyan szállították
Információ a betegek tanácsadásáról
Janumet, szitagliptin és metformin-hidroklorid, betegtájékoztató (egyszerűen angolul)
FIGYELMEZTETÉS: LAKTOS ACIDOZIS
A tejsavas acidózis ritka, de súlyos szövődmény, amely a metformin felhalmozódása miatt fordulhat elő. A kockázat növekszik az olyan állapotok mellett, mint a szepszis, kiszáradás, túlzott alkoholfogyasztás, májelégtelenség, vesekárosodás és akut pangásos szívelégtelenség.
A kezdet gyakran finom, csak nem specifikus tünetekkel, például rossz közérzettel, myalgiákkal, légzési zavarral, növekvő aluszékonysággal és nem specifikus hasi szorongással járnak. A laboratóriumi rendellenességek magukban foglalják az alacsony pH-értéket, a megnövekedett anionrést és a megnövekedett vér laktáttartalmat.
Ha acidózist gyanítanak, Janumet1 abba kell hagyni, és a beteget azonnal kórházba kell hozni. [Lát Figyelmeztetések és óvintézkedések]
Javallatok és felhasználás
A Janumet étrend és testmozgás kiegészítéseként javasolt a 2. típusú diabetes mellitusban szenvedő felnőttek glikémiás kontrolljának javítására, ha a szitagliptin és a metformin kezelése is megfelelő. [Lát Klinikai vizsgálatok.]
Fontos felhasználási korlátozások
A Janumet nem alkalmazható 1. típusú cukorbetegségben szenvedő betegeknél vagy diabéteszes ketoacidózis kezelésére, mivel ebben az esetben nem lenne hatékony.
A Janumet-et inzulinnal kombinációban nem vizsgálták.
felső
Adagolás és adminisztráció
Ajánlott adagolás
A vérnyomáscsökkentő Janumet-terápia adagolását a beteg jelenlegi kezelési rendje alapján kell meghatározni, hatékonysága és tolerálhatósága, miközben nem haladja meg a 100 mg szitagliptin és a 2000 mg maximális ajánlott napi adagot metformin. A kezdeti kombinációs terápiát vagy a kombinált terápia fenntartását egyedileg kell meghatározni, és az egészségügyi szolgáltató mérlegelési jogkörébe kell hagyni.
A Janumet-et általában naponta kétszer, étkezés közben, fokozatos adagnöveléssel kell beadni, hogy csökkentik a metformin okozta gastrointestinalis (GI) mellékhatásokat.
A Janumet kezdő adagjának a beteg jelenlegi kezelési rendjén kell alapulnia. A Janumet-et naponta kétszer, étkezés közben kell beadni. A következő adagok állnak rendelkezésre:
50 mg szitagliptin / 500 mg metformin-hidroklorid
50 mg szitagliptin / 1000 mg metformin-hidroklorid.
Azok a betegek, akiknek önmagukban étkezése és testmozgása nem megfelelő
Ha a szitagliptin és metformin tartalmú kombinált tablettaval történő kezelést megfelelőnek tekintik 2-es típusú diabetes mellitusban szenvedő betegek esetén nem kielégítően kontrollált étrend és testmozgás mellett, az ajánlott kezdő adag 50 mg szitagliptin / 500 mg metformin-hidroklorid kétszer napi. Azoknál a betegeknél, akiknél ez a dózis nem kielégítően szabályozza a glikémiát, napi kétszer 50 mg szitagliptin / 1000 mg metformin-hidroklorid adagolható.
A metformin monoterápiában nem kielégítően kontrollált betegek
Ha a szitagliptin és metformin tartalmú kombinált tablettával történő kezelést megfelelőnek ítélik olyan beteg számára, akinek a metformin önmagában történő kezelése nem megfelelő, a A Janumet ajánlott kezdő adagjának a szitagliptinnek napi kétszer 50 mg-os adaggal (100 mg teljes napi adag) kell lennie, és a metformin adagjának már hozni. Azon betegek számára, akik napi kétszer 850 mg metformint szednek, a Janumet ajánlott kezdő adagja napi kétszer 50 mg szitagliptin / 1000 mg metformin hidroklorid.
A szitagliptin monoterápiában nem kielégítően kontrollált betegek
Ha a szitagliptin és metformin tartalmú kombinált tablettával történő terápiát megfelelőnek tekintik a beteg számára önmagában szitagliptin mellett, a Janumet ajánlott kezdő adagja kétszer 50 mg szitagliptin / 500 mg metformin-hidroklorid. napi. Azok a betegek, akiknél ez az adag nem kielégítően kontrollálható, napi kétszer 50 mg szitagliptin / 1000 mg metformin-hidroklorid dózisra adható titrálással. A veseelégtelenségre korrigált szitagliptin monoterápiában részesülő betegeket nem szabad átváltani a Janumet-re. Ellenjavallatok].
Betegek, akik a szitagliptin és a metformin együttes adagolásáról váltanak át
Azoknál a betegeknél, akik metadinnal együtt adják a szitagliptinről, a Janumet a már alkalmazott szitagliptin és metformin dózissal kezdhető el.
A következő antihiperglikémiás szerek bármelyikével: szitagliptin, metformin vagy szulfonilkarbamid kettős kombinációs terápiájában nem megfelelő ellenőrzés alatt álló betegek
Ha megfelelőnek tekintik a szitagliptin és metformin tartalmú kombinált tabletta kezelését beállítva, a Janumet szokásos kezdő adagjának a szitagliptinnek napi kétszer 50 mg-os adaggal kell rendelkeznie (összesen 100 mg) napi adag). A metformin összetevő kezdő dózisának meghatározásakor figyelembe kell venni a beteg glikémiás kontroll szintjét és a metformin jelenlegi dózisát (ha van ilyen). A metformingal kapcsolatos gastrointestinalis (GI) mellékhatások csökkentése érdekében mérlegelni kell az adag fokozatos növelését. Azok a betegek, akik jelenleg szulfonilurea-kezelést kapnak vagy kezdnek, alacsonyabb szulfonil-karbamid-dózist igényelhetnek a hipoglikémia kockázatának csökkentése érdekében [lásd Figyelmeztetések és óvintézkedések].
Nem végeztek külön vizsgálatokat a Janumet biztonságosságának és hatékonyságának vizsgálatára azoknál a betegeknél, akiket korábban más orális antihiperglikémiás szerekkel kezeltek, és a Janumet-re váltották. A 2. típusú cukorbetegség terápiájában bekövetkező bármilyen változást körültekintéssel és megfelelő ellenőrzéssel kell elvégezni, mivel változhat a glikémiás kontrollban.
felső
Adagolási formák és erősségek
- Az 50 mg / 500 mg tabletta halvány rózsaszínű, kapszula alakú, filmbevonatú tabletta, egyik oldalán "575" felirattal.
- Az 50 mg / 1000 mg tabletta piros, kapszula alakú, filmbevonatú tabletta, egyik oldalán "577" jelöléssel ellátva.
felső
Ellenjavallatok
A Janumet (szitagliptin / metformin HCl) ellenjavallt az alábbi betegek esetén:
- Vesebetegség vagy veseműködési zavar, például a szérum kreatinin-szintjének â ‰ ¥ mg ¥ ¥ ¥ ma ma (férfiak), ‰ ‰ mg mg 1,4 mg / dL [nők] vagy rendellenes kreatinin-clearance, amely olyan állapotokból is származhat, mint például kardiovaszkuláris összeomlás (sokk), akut miokardiális infarktus és szeptikemia [lát Figyelmeztetések és óvintézkedések].
- Akut vagy krónikus metabolikus acidózis, beleértve a diabéteszes ketoacidózist, kómával vagy anélkül.
- A Janumet vagy a szitagliptin (a Janumet egyik összetevője) súlyos túlérzékenységi reakciója, például anafilaxia vagy angioödéma. [Lát Figyelmeztetések és óvintézkedések és Mellékhatások.]
A Janumet átmenetileg abba kell hagyni az intravaszkuláris radiológiai vizsgálatokon átesett betegek körében jódos kontrasztanyagok beadása, mivel az ilyen termékek használata a vesék akut megváltozását eredményezheti funkció [lásd Figyelmeztetések és óvintézkedések].
felső
Figyelmeztetések és óvintézkedések
Tejsavas acidózis
Metformin-hidroklorid
A tejsavas acidózis ritka, de súlyos anyagcsere-komplikáció, amely a metformin felhalmozódása miatt fordulhat elő a Janumet-kezelés alatt; amikor bekövetkezik, az esetek kb. 50% -ában halálos. Tejsavas acidózis számos patofiziológiás állapotgal együtt járhat, beleértve a cukorbetegséget is, valamint bármikor, amikor jelentős szöveti hipoperfúzió és hypoxemia áll fenn. A tejsavas acidózist magas vérlaktát-szint (> 5 mmol / L), csökkentett vér pH-érték, elektrolit-zavarok, megnövekedett anionrés, valamint megnövekedett laktát / piruvát arány jellemzi. Ha a metformin a tejsavas acidózis oka, a metformin plazmaszintje általában> 5 ¼ μg / ml.
A metformin-hidrokloriddal kezelt betegekben a tejsavas acidózis gyakorisága nagyon alacsony (körülbelül 0,03 eset / 1000 betegév, körülbelül 0,015 halálos eset / 1000) beteg-év). A klinikai vizsgálatokban a metforminnak több mint 20 000 betegévben történt expozíciója során nem jelentettek tejsavas acidózist. A bejelentett esetek elsősorban szignifikáns veseelégtelenségben szenvedő cukorbetegekben fordultak elő, ideértve mind a belső vesét betegség és vesehipoperfúzió, gyakran több egyidejű orvosi / műtéti probléma és több egyidejű kezelés során gyógyszereket. Pangásos szívelégtelenségben szenvedő, farmakológiai kezelést igénylő betegek, különösen instabil vagy akut pangásos szívelégtelenség, akiknél fennáll a hypoperfúzió és a hypoxemia kockázata, fokozott a tejsav kockázata acidózis. A tejsavas acidózis kockázata növekszik a veseelégtelenség mértékével és a beteg életkorral. A tejsavas acidózis kockázatát tehát jelentősen csökkentheti a metformin szedő betegek vesefunkciójának rendszeres monitorozása és a metformin minimális hatásos adagjának használata. Az idősek kezelését különösen a vesefunkció gondos ellenőrzésével kell kísérni. A metformin-kezelést csak 80 éves betegekben szabad elkezdeni, kivéve, ha a kreatinin-clearance-t mérik bizonyítja, hogy a vesefunkció nem csökken, mivel ezek a betegek hajlamosabbak a tejsavas acidózis kialakulására. Ezen túlmenően a metformin haladéktalanul meg kell szüntetni minden olyan állapot jelenlétében, amely hipoxémiával, dehidrációval vagy szepszissel jár. Mivel a károsodott májfunkció jelentősen korlátozhatja a laktát tisztulásának képességét, általában el kell kerülni a metformint a májbetegség klinikai vagy laboratóriumi tüneteit mutató betegek esetén. A betegeket óvatosan kell figyelni a túlzott alkoholfogyasztásra - akár akut, akár krónikus - metformin szedésekor, mivel az alkohol fokozza a metformin-hidroklorid laktát-anyagcserére gyakorolt hatását. Ezenkívül a metformin átmeneti abba kell hagyni minden intravaszkuláris radiokontraszt vizsgálat előtt és bármilyen műtéti eljárás előtt [lásd Figyelmeztetések és óvintézkedések].
A tejsavas acidózis kialakulása gyakran finom, és csak olyan nem specifikus tünetekkel jár, mint a rossz közérzet, myalgiák, légzési zavarok, növekvő aluszékonyság és nem specifikus hasi szorongás. Előfordulhat, hogy hipotermia, hipotenzió és rezisztens bradyarrhythmiák jelentősebb acidózissal járnak. A betegnek és a beteg orvosának tisztában kell lennie az ilyen tünetek lehetséges fontosságával, és arra kell utasítani, hogy a beteg azonnal értesítse az orvost, ha azok jelentkeznek [lásd Figyelmeztetések és óvintézkedések]. A metformin visszavonását a helyzet tisztázásáig vissza kell vonni. A szérum elektrolitok, ketonok, vércukorszint és ha szükséges, a vér pH-ja, a laktát és még a vér metformin szintje is hasznos lehet. Ha a beteget bármilyen metformin dózissal stabilizálják, a gastrointestinalis tünetek, amelyek a kezelés megkezdésekor gyakoriak, nem valószínű, hogy gyógyszerfüggőek. A gastrointestinalis tünetek későbbi előfordulását tejsavas acidózis vagy más súlyos betegség okozhatja.
Az éhomi vénás plazma-laktát szintje a normál felső határa fölött, de kevesebb, mint 5 mmol / L metforminnal szedő betegeknél nem feltétlenül jelenti a közelgő tejsav acidózis, és egyéb mechanizmusokkal magyarázható, mint például a rosszul szabályozott cukorbetegség vagy elhízás, erőteljes fizikai aktivitás vagy a minták kezelésének technikai problémái [lát Figyelmeztetések és óvintézkedések].
A tejsavas acidózist minden olyan metabolikus acidózisban szenvedő cukorbetegségben szenvedő betegnél gyanúsítani kell, akinek nincs ketoacidózisának bizonyítéka (ketonuria és ketonemia).
A tejsavas acidózis orvosi sürgősség, amelyet kórházi környezetben kell kezelni. Tejsavas acidózisban szenvedő, metformin szedő betegnél a gyógyszert azonnal abba kell hagyni, és haladéktalanul el kell indítani az általános szupportív támogató intézkedéseket. Mivel a metformin-hidroklorid dializálható (jó hemodinamika mellett 170 ml / perc hézaggal) állapotok), az acidózis kijavításához és a felhalmozódott anyag eltávolításához javasolt az azonnali hemodialízis metformin. Az ilyen kezelés gyakran a tünetek azonnali visszafordulását és a gyógyulást eredményezi [lásd Ellenjavallatok; Figyelmeztetések és óvintézkedések].
Károsult májműködés
Mivel a károsodott májfunkciót egyes tejsavas acidózis esetekkel társították, a Janumet-et általában kerülni kell a májbetegség klinikai vagy laboratóriumi bizonyítéka esetén.
A vesefunkció értékelése
A metformin és a szitagliptin ismert módon lényegesen kiválasztódik a vesén keresztül. A metformin felhalmozódásának és a tejsavas acidózis kockázata a veseműködés károsodásának mértékével növekszik. Ezért azok a betegek, akiknek szérum kreatininszintje meghaladja koruk normál felső határát, nem kaphatják a Janumet-et. Időskorban a Janumet-et gondosan titrálni kell a megfelelő glikémiás hatás minimális dózisának meghatározása érdekében, mivel az öregedés csökkent veseműködéssel járhat. [Lát Figyelmeztetések és óvintézkedések és Használat meghatározott populációkban.]
A Janumet-kezelés megkezdése előtt, majd ezt követően legalább évente a veseműködést meg kell vizsgálni, és a normál állapotát ellenőrizni kell. Olyan betegeknél, akiknél vesefunkció kialakulása várható, különösen idős betegekben, vese A vesefunkciót gyakrabban kell értékelni, és a Janumet-kezelést abba kell hagyni, ha vesekárosodásra utaló bizonyíték áll fenn jelenlegi.
B-vitamin12 Levels
A metformin 29 hetes kontrollált klinikai vizsgálatában a korábban normál szérum B-vitamin szubnormal szintjére csökkent12 szintet klinikai tünetek nélkül a betegek kb. 7% -ánál figyelték meg. Ez a csökkenés, valószínűleg a B-vel való interferencia miatt12 abszorpció a B-ből12-intrinsic faktor komplex, azonban nagyon ritkán társul vérszegénységgel, és a metformin vagy B-vitamin abbahagyásával gyorsan reverzibilisnek tűnik.12 pótlás. Javasolt a hematológiai paraméterek évenkénti mérése a Janumet-kezelésben részesülő betegeknél, és minden látható rendellenességet megfelelő módon meg kell vizsgálni és kezelni. [Lát Mellékhatások.]
Bizonyos egyének (azok, akik nem kielégítő B-vitaminnal rendelkeznek)12 vagy kalciumbevitel vagy felszívódás) hajlamos a szubnormal B-vitamin kialakulására12 szinteket. Ezekben a betegekben rutin szérum B-vitamin12 hasznos lehet a két-három éves időközönkénti mérés.
Alkohol bevitel
Az alkoholról ismert, hogy fokozza a metformin hatását a laktát anyagcserére. Ezért a Janumet-kezelés alatt a betegeket figyelmeztetni kell az akut vagy krónikus túlzott alkoholfogyasztásra.
Műtéti beavatkozások
A Janumet alkalmazását ideiglenesen fel kell függeszteni minden műtéti eljáráshoz (kivéve a korlátozott bevitellel nem járó kisebb eljárásokat) ételekből és folyadékokból), és addig nem szabad újrakezdeni, amíg a páciens szájon át nem vesz részt, és a veseműködés Normál.
Korábban kontrollált 2. típusú cukorbetegségben szenvedő betegek klinikai állapotának változása
2-es típusú cukorbetegségben szenvedő, a Janumet korábban jól kontrollált betege, aki laboratóriumi rendellenességeket vagy klinikai tüneteket mutat a betegséget (különösen homályos és rosszul definiált betegséget) haladéktalanul ki kell értékelni a ketoacidózis vagy a tejsavas bizonyítéka szempontjából acidózis. Az értékelésnek ki kell terjednie a szérum elektrolitokra és ketonokra, a vércukorszintre és ha szükséges, a vér pH-jára, laktát-, piruvát- és metforminszintre. Bármelyik formájú acidózis esetén a Janumet-et azonnal le kell állítani, és meg kell kezdeni az egyéb megfelelő korrekciós intézkedéseket.
Használat olyan gyógyszerekkel, amelyekről ismert, hogy hipoglikémiát okoznak
A szitagliptin
Mint általában a szulfonilkarbamiddal kombinációban alkalmazott egyéb vérnyomáscsökkentő szerek esetében, amikor a szitagliptinet metforminnal és egy szulfonilurea, egy olyan gyógyszer, amely hypoglykaemiát okoz, a hypoglykaemia előfordulása megnőtt a placebóhoz képest, metforminnal és egy szulfonilkarbamid [lásd Mellékhatások]. Ezért az inzulin szekretagógot (például szulfonilkarbamidot, meglitinidet) kapó betegeknek alacsonyabb adagra is szükség lehet az inzulin szekretagóg kezelésére a hipoglikémia kockázatának csökkentése érdekében. Adagolás és adminisztráció].
Metformin-hidroklorid
Hipoglikémia nem fordul elő olyan betegekben, akik csak metforminnal szednek szokásos alkalmazás körülmények között, hanem akkor fordulhat elő, ha a kalóriabevitel hiányos, ha az erőteljes testmozgást nem kompenzálja a kalória-kiegészítés vagy más glükózszint-csökkentő szerekkel (például szulfonilkarbamidokkal és inzulinnal) történő egyidejű alkalmazás során vagy etanol. Idős, fogyatékossággal vagy alultáplált betegek, valamint mellékvese- vagy hipofízis elégtelenség vagy alkoholmérgezéses betegek különösen érzékenyek a vércukorszintű hatásokra. A hipoglikémiát nehéz lehet felismerni időskorúak és β-adrenerg blokkoló gyógyszereket szedő emberek körében.
Egyidejű, a veseműködést vagy a metformin elrendeződését befolyásoló gyógyszerek
Egyidejű gyógyszer (ek), amelyek befolyásolhatják a vesefunkciót, vagy jelentős hemodinamikai változást okozhatnak, vagy bekövetkezhetnek befolyásolják a metformin, például a kationos gyógyszerek, amelyek a vesék tubuláris szekréciója révén eliminálódnak, elvezetését [lát Gyógyszerkölcsönhatások], óvatosan kell alkalmazni.
Radiológiai vizsgálatok intravaszkuláris jódos kontrasztanyagokkal
Intravaszkuláris kontrasztvizsgálatok jódos anyagokkal (például intravénás urogram, intravénás kolangiográfia, angiográfia és számítógépes tomográfia (CT) vizsgálatok intravaszkuláris kontrasztanyagokkal) a veseműködés akut megváltozásához vezethet, és metforminnal kezelt betegekben tejsavas acidózissal összefüggésben lehetnek [lásd Ellenjavallatok]. Ezért azoknál a betegeknél, akiknél ilyen vizsgálatot terveznek, a Janumet alkalmazását ideiglenesen abba kell hagyni a A beavatkozást követően 48 órán át visszatartják, és csak a veseműködés újbóli felmérése és a legyen normális.
Hipoxiás állapotok
Szív-érrendszeri összeomlás (sokk) bármilyen okból, akut pangásos szívelégtelenség, akut miokardiális infarktus és egyéb, hipoxémiával jellemezhető állapotok társultak a tejsavas acidózissal, és prerenal is kialakulhatnak azotemia. Ha ilyen események fordulnak elő a Janumet-kezelésben részesülő betegeknél, a gyógyszert haladéktalanul abba kell hagyni.
A vércukor ellenőrzésének elvesztése
Ha a diabéteszes kezelési mód szerint stabilizált beteget olyan stressznek teszik ki, mint például láz, trauma, fertőzés vagy műtét, átmenetileg a glikémiás kontroll elvesztése léphet fel. Ilyenkor szükség lehet a Janumet visszatartására és az inzulin ideiglenes beadására. A Janumet újratelepíthető az akut epizód megszűnése után.
Túlérzékenységi reakciók
A forgalomba hozatalt követően súlyos túlérzékenységi reakciókról számoltak be a szitagliptinnel, a Janumet egyik alkotórészével kezelt betegekben. Ezek a reakciók magukban foglalják az anafilaxiát, angioödémát és exfoliativ bőrbetegségeket, beleértve a Stevens-Johnson-szindrómát. Mivel ezekről a reakciókról önkéntesen számolnak be a bizonytalan méretű lakosságból, általában ez a helyzet ezek gyakoriságát nem lehet megbízhatóan megbecsülni, vagy nem lehet okozati összefüggést megállapítani a drogok expozíciójával. Ezek a reakciók a szitagliptin-kezelés megkezdését követő első 3 hónapban jelentkeztek, néhány jelentésben az első adag után. Túlérzékenységi reakció gyanúja esetén abba kell hagyni a Janumet alkalmazását, fel kell mérni az eset más lehetséges okait és indítani a cukorbetegség alternatív kezelését. [Lát Mellékhatások.]
Makrovaszkuláris eredmények
Nem végeztek klinikai vizsgálatokat, amelyek meggyőző bizonyítékot szolgáltatnának a makrovaszkuláris kockázat csökkentésére a Janumet vagy bármely más antidiabetikus gyógyszer esetén.
felső
Mellékhatások
Klinikai vizsgálatok tapasztalata
Mivel a klinikai vizsgálatokat nagyon változó körülmények között végzik, az a A drogot nem lehet közvetlenül összehasonlítani egy másik gyógyszer klinikai vizsgálatában szereplő arányokkal, és nem tükrözhetik a gyakorlat.
Szitagliptin és metformin együttes alkalmazás a 2. típusú cukorbetegségben szenvedő betegek esetén, akik étrend és testmozgás során nem megfelelőek
Az 1. táblázat foglalja össze a leggyakoribb (a betegek 5% -a) 24 órán át jelentett mellékhatásokat (függetlenül a vizsgáló okozati összefüggésének értékelésétől) placebo-kontrollos faktorialis vizsgálat, amelyben a szitagliptin és a metformin együttes adása a 2. típusú cukorbetegségben szenvedő betegeknek nem volt kielégítően szabályozott az étrendben és testmozgás.
1. táblázat: A szitagliptin és a metformin együttes beadása a 2. típusú cukorbetegségben szenvedő betegeknek, akik étrendje és testmozgásuk alatt nem megfelelő az ellenőrzés: mellékhatások Jelentettek (függetlenül a vizsgáló ok-okozati összefüggések értékelésétől) a kombinált terápiát kapó betegek ~ 5% -ánál (és nagyobb, mint a kapott betegeknél) Placebo)*
| Betegek száma (%) | ||||
Placebo |
A szitagliptin 100 mg QD |
Metformin 500 mg / Metformin 1000 mg két alkalommal†|
A szitagliptin 50 mg / nap Metformin 500 mg / Metformin 1000 mg két alkalommal†|
|
| N = 176 | N = 179 | N = 364†| N = 372†| |
| ||||
| Hasmenés | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) |
| Felső légúti fertőzés | 9 (5.1) | 8 (4.5) | 19 (5.2) | 23 (6.2) |
| Fejfájás | 5 (2.8) | 2 (1.1) | 14 (3.8) | 22 (5.9) |
Szitagliptin-kiegészítő kezelés 2-es típusú cukorbetegségben szenvedő betegeknél, akik önmagában nem kielégítően ellenőrzött
Egy 24 hetes, placebo-kontrollos vizsgálatban a napi egyszeri adagban beadott 100 mg szitagliptin adagolása mellett, a napi kétszer metformin kezelési rendbe nem került sor a betegek ~ 5% -ánál, és gyakrabban, mint a placebo. A kezelés abbahagyása a klinikai mellékhatások miatt hasonló volt a placebóval kezelt csoporthoz (szitagliptin és metformin, 1,9%; placebo és metformin, 2,5%).
A hipoglikémia
A hypoglykaemia mellékhatásai a hypoglykaemia összes bejelentésén alapultak; egyidejű glükózmérés nem volt szükséges. A hipoglikémia előre meghatározott mellékhatásainak általános előfordulási gyakorisága az étrend és a testmozgás során nem megfelelően kontrollált 2. típusú cukorbetegségben szenvedő betegekben 0,6% volt placebót kapó betegek 0,6% -a, csak szitagliptin kezelésben részesülő betegekben, 0,8% azokban a betegekben, akiket csak metformin adtak, és 1,6% azokban a betegekben, akik szitagliptin kezelést kaptak metformin. 2-es típusú cukorbetegségben szenvedő betegeknél, akiket önmagában a metformin önmagában nem tud megfelelően kezelni, a káros mellékhatások általános előfordulási gyakorisága a hypoglykaemia reakciói 1,3% -ot mutattak a szitagliptin kiegészítéssel kezelt betegekben és 2,1% -ot azoknak a betegeknek placebo.
Emésztőrendszeri mellékhatások
Az előre kiválasztott gyomor-bélrendszeri mellékhatások gyakorisága hasonló volt a szitagliptin és metformin kezelésben részesülő betegeknél, mint amelyeket csak a metforminnal kezelt betegek esetében jelentettek. Lásd a 2. táblázatot.
2. táblázat: Előzetesen kiválasztott gastrointestinalis mellékhatások (függetlenül a vizsgáló ok-okozati összefüggésének értékelésétől), szitagliptin és metformin kezelésben részesülő 2. típusú cukorbetegségben szenvedő betegek esetében jelentettek.
| Betegek száma (%) | ||||||
| A szitagliptin és a metformin vizsgálata nem kielégítően ellenőrzött betegekben a diéta és a testmozgás |
A szitagliptin-kiegészítő vizsgálata egyedül metforminnal nem kielégítően ellenőrzött betegeknél | |||||
Placebo |
A szitagliptin 100 mg QD |
Metformin 500 mg / Metformin 1000 mg két alkalommal* |
A szitagliptin 50 mg / nap Metformin 500 mg / Metformin 1000 mg két alkalommal* |
Placebo és Metformin - naponta 1500 mg |
100 mg szitagliptin QD és Metformin - naponta 1500 mg |
|
| N = 176 | N = 179 | N = 364 | N = 372 | N = 237 | N = 464 | |
| ||||||
| Hasmenés | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) | 6 (2.5) | 11 (2.4) |
| Hányinger | 2 (1.1) | 2 (1.1) | 20 (5.5) | 18 (4.8) | 2 (0.8) | 6 (1.3) |
| Hányás | 1 (0.6) | 0 (0.0) | 2 (0.5) | 8 (2.2) | 2 (0.8) | 5 (1.1) |
| Hasi fájdalom†| 4 (2.3) | 6 (3.4) | 14 (3.8) | 11 (3.0) | 9 (3.8) | 10 (2.2) |
Szitagliptin metforminnal és glimepiriddel kombinálva
Egy 24 hetes placebo-kontrollos vizsgálatban a 100 mg szitagliptin kiegészítésként történő kezelésében 2-es típusú cukorbetegségben szenvedő betegekben, akiknek a metformin és glimepirid kezelése nem volt kielégítően szabályozott (szitagliptin, N = 116; placebo, N = 113), a jelentett mellékhatások, függetlenül attól, hogy a vizsgáló értékelte-e az okozati összefüggést a betegek ~ 5% -ánál szitagliptin-kezelésben részesültek, és a placebóval kezelt betegeknél gyakrabban voltak: hypoglykaemia (szitagliptin, 16,4%; placebo, 0,9%) és fejfájás (6,9%, 2,7%).
A szitagliptin és a metformin kombinációjával nem figyeltünk meg klinikailag jelentős változásokat az élettani jelekben vagy az EKG-ben (beleértve a QTc-intervallumot).
A szitagliptin monoterápiával kapcsolatos leggyakoribb mellékhatás, a vizsgálótól függetlenül az ok-okozati összefüggések értékelése a betegek ~ 5% -ánál, és a placebóval kezelt betegeknél gyakoribb volt nasopharyngitis.
A metformin-terápia megkezdésekor a leggyakoribb (> 5%) megállapított mellékhatások a hasmenés, émelygés / hányás, puffadás, hasi diszkomfort, emésztési zavarok, asthenia és fejfájás.
Laboratóriumi tesztek
A szitagliptin
A laboratóriumi mellékhatások előfordulási gyakorisága hasonló volt a szitagliptintel és metforminnal kezelt betegekben (7,6%), mint a placebóval és a metforminnal kezelt betegekkel (8,7%). A legtöbb, de nem az összes vizsgálatban a fehérvérsejtszám kismértékben növekedett (kb. 200 sejt / mikroliter különbség a vérvédő fehérjében és a placebóban; az átlagos kiindulási WBC értéke körülbelül 6600 sejt / mikroliter) volt megfigyelhető a neutrofilek kismértékű növekedése miatt. A laboratóriumi paraméterek ezen változása nem tekinthető klinikailag relevánsnak.
Metformin-hidroklorid
A metformin 29 hetes kontrollált klinikai vizsgálatában a korábban normál szérum B-vitamin szubnormal szintjére csökkent12 szintet klinikai tünetek nélkül a betegek kb. 7% -ánál figyelték meg. Ez a csökkenés, valószínűleg a B-vel való interferencia miatt12 abszorpció a B-ből12-intrinsic faktor komplex, azonban nagyon ritkán társul vérszegénységgel, és a metformin vagy B-vitamin abbahagyásával gyorsan reverzibilisnek tűnik.12 pótlás. [Lát Figyelmeztetések és óvintézkedések.]
Postmarketing tapasztalat
A Janumet vagy a szitagliptin, a Janumet egyik összetevője, az alkalmazás utáni további alkalmazása során a következő további mellékhatásokat azonosították. Mivel ezekről a reakciókról önkéntesen számolnak be a bizonytalan méretű lakosságból, általában ez a helyzet ezek gyakoriságát nem lehet megbízhatóan megbecsülni, vagy nem lehet okozati összefüggést megállapítani a drogok expozíciójával.
A túlérzékenységi reakciók közé tartozik az anafilaxia, angioödéma, kiütés, urticaria, bőrvaszkulitisz és exfoliativ bőrbetegségek, beleértve a Stevens-Johnson-szindrómát [lásd Figyelmeztetések és óvintézkedések]; felső légúti fertőzés; májenzimszint emelkedés; hasnyálmirigy-gyulladás.
felső
Gyógyszerkölcsönhatások
Kationos gyógyszerek
Kationos gyógyszerek (például amilorid, digoxin, morfin, prokainamid, kinidin, kinin, ranitidin, triamterén, trimetoprim vagy vankomicin), amelyek A vesék tubuláris szekréciójával eliminálható elméletileg kölcsönhatásba léphet a metforminnal, mivel versenyben áll a renális tubuláris transzportért rendszereket. Ilyen egészséges egészséges önkénteseknél megfigyelték a metformin és az orális cimetidin közötti ilyen interakciót mind az egyszeri, mind a többszörös dózisú metformin-cimetidin esetében. gyógyszerkölcsönhatásokkal kapcsolatos vizsgálatok: a metformin csúcs plazma és teljes vér koncentrációjának 60% -kal, a plazma és a teljes vér metformin 40% -kal növekedésével AUC. Az eliminációs felezési idő nem változott az egydózisú vizsgálatban. A metformin nem befolyásolta a cimetidin farmakokinetikáját. Noha az ilyen kölcsönhatások elméleti jellegűek maradnak (a cimetidin kivételével), a Janumet és / vagy a interferáló gyógyszer ajánlott azoknál a betegeknél, akik kationos gyógyszereket szednek, amelyek a proximalis vese tubuláris szekrécióján keresztül választódnak ki rendszer.
digoxin
Kismértékben megnőtt a görbe alatti terület (AUC, 11%) és az átlagos csúcskoncentráció (Cmax, 18%) digoxint, 100 mg szitagliptin együttes alkalmazásával 10 napig. Ez a növekedés nem valószínű, hogy klinikai szempontból jelentős. A digoxin, mint kationos gyógyszer, képes a metforminval versengni a renális vese tubuláris transzportrendszereiben, ezáltal befolyásolva mind a digoxin, a metformin, mind a kettő szérumkoncentrációját. A digoxinnal kezelt betegeket megfelelően monitorozni kell. A digoxin vagy a Janumet adagjának módosítása nem javasolt.
gliburidot
Az egydózisú interakciós vizsgálatban 2. típusú cukorbetegségben szenvedő betegekben a metformin és a gliburid együttes alkalmazása nem változtatott sem a metformin farmakokinetikájában, sem a farmakodinámiában. Csökken a glicurid AUC és C értékemax megfigyelték, de nagyon változóak voltak. A vizsgálat egydózisú jellege, valamint a vér gliceridszintje és a farmakodinámiás hatások közötti korreláció hiánya e kölcsönhatás klinikai jelentőségét bizonytalanná teszi.
furoszemid
Egészséges alanyokon végzett egydózisú metformin-furoszemid gyógyszerkölcsönhatási vizsgálat kimutatta, hogy mindkét vegyület farmakokinetikai paramétereit befolyásolja az együttes alkalmazás. A furozemid növelte a metformin plazmáját és a vér C-szintjétmax 22% -kal, a vér AUC-ját pedig 15% -kal, a metformin renális clearance-e lényeges változása nélkül. Metforminnal együtt adva a Cmax és a furoszemid AUC értéke 31% -kal, illetve 12% -kal kisebb volt, mint önmagában történő alkalmazás esetén, és a A terminális felezési idő 32% -kal csökkent, anélkül, hogy a furoszemid vesében jelentősen megváltozott volna távolság. Nincs információ a metformin és a furoszemid kölcsönhatásáról, ha krónikusan adják be.
A nifedipin
Egy egydózisú, metformin-nifedipin gyógyszerkölcsönhatási vizsgálat egészséges egészséges önkénteseknél kimutatta, hogy a nifedipin együttes alkalmazása növeli a plazma metformin Cmax és AUC 20% -kal, illetve 9% -kal, és növeli a vizelettel kiválasztódó mennyiséget. Tmax és a felezési időt nem befolyásolta. Úgy tűnik, hogy a nifedipin fokozza a metformin felszívódását. A metformin minimális hatással volt a nifedipinre.
A metformin használata más gyógyszerekkel
Egyes gyógyszerek általában hiperglikémiát okoznak, és a glikémiás kontroll elvesztéséhez vezethetnek. Ezek közé a gyógyszerek közé tartoznak a tiazidok és más diuretikumok, kortikoszteroidok, fenotiazinok, pajzsmirigy-termékek, ösztrogének, orális fogamzásgátlók, fenitoin, nikotinsav, szimpatomimetikumok, kalciumcsatorna-gátló gyógyszerek és izoniazid. Amikor ilyen gyógyszereket adnak be a Janumet-et kapó betegnek, a beteget gondosan meg kell figyelni, hogy fennálljon a megfelelő glikémiás kontroll.
Egészséges önkéntesekben a metformin és a propranolol, valamint a metformin és az ibuprofen farmakokinetikáját nem befolyásolta az egydózisú interakciós vizsgálatokban történő együttes alkalmazás.
A metformin elhanyagolható mértékben kötődik a plazmafehérjékhez, ezért kevésbé valószínű, hogy kölcsönhatásba lép nagy mértékben fehérjehez kötött gyógyszerekkel, például szalicilátok, szulfonamidok, klóramfenikol és probenecid, összehasonlítva a szérummal erősen kötődő szulfonilkarbamidokkal fehérjéket.
felső
Használat meghatározott populációkban
Terhesség
B terhességi kategória:
Janumetet
A Janumettel vagy annak egyes alkotóelemeivel terhes nőkön nincs megfelelő és jól ellenőrzött vizsgálat; ezért a Janumet biztonságossága terhes nőknél nem ismert. A Janumet terhesség alatt csak akkor szabad alkalmazni, ha egyértelműen szükséges.
Merck & Co., Inc. nyilvántartást vezet a Janumetnek kitett nők terhesség ideje alatt bekövetkezett terhességének kimenetele érdekében. Az egészségügyi szolgáltatókat arra ösztönzik, hogy jelentsék a Janumet bármilyen prenatális expozícióját a Terhességi Nyilvántartás telefonszámon (800) 986-8999.
A Janumet-ben a kombinált termékekkel nem végeztek állatkísérleteket a reprodukcióra gyakorolt hatások értékelésére. A következő adatok a szitagliptintel vagy a metforminnal külön-külön végzett vizsgálatok eredményein alapulnak.
A szitagliptin
Reprodukciós vizsgálatokat patkányokon és nyulakon végeztek. A szitagliptin 125 mg / kg-ig terjedő adagjai (a humán expozíció körülbelül tizenkétszorosa a maximális ajánlott humán adagnál) nem befolyásolták a termékenységet vagy károsították a magzatot. Terhes nőkben azonban nincs megfelelő és jól ellenőrzött vizsgálat a szitagliptinről.
A szitagliptin terhes nőstény patkányoknak és nyulaknak a 6-20. Terhesség napjától kezdve (organogenezis) nem volt teratogén 250 mg / kg-os orális dózisokban. (patkányok) és 125 mg / kg (nyulak), vagy kb. 30-szor és 20-szorosa az emberi expozíciónak az AUC alapján a napi 100 mg-os maximális ajánlott adaggal (MRHD). összehasonlítások. A magasabb dózisok az utódoknál a bordák rendellenességeinek előfordulását növelték 1000 mg / kg-nál, vagyis az ember expozíciójának mintegy százszorosa az MRHD-nál.
A szitagliptin nőstény patkányoknak a 6. terhesség napjától a 21. szoptatás napjáig adták a hím és nőstény utódok testtömegét 1000 mg / kg-nál. Patkányok utódjain nem figyeltünk meg funkcionális vagy viselkedési toxicitást.
A vemhes patkányoknak adott szitagliptin plasztikus transzferje körülbelül 45% volt 2 óra múlva, 80% pedig 24 órával az adagolás után. A vemhes nyulaknak adott szitagliptin plasztikus transzferje körülbelül 66% volt 2 óra múlva, 30% pedig 24 óra múlva.
Metformin-hidroklorid
A metformin nem volt teratogén patkányokban és nyulakban, napi 600 mg / kg dózisokig. Ez a patkányok és a nyulak testfelületének összehasonlítása alapján ez az expozíció kb. Kétszeresére és 6-szorosa az emberi javasolt napi maximális adagnak. A magzati koncentráció meghatározása kimutatta a metformin részleges placenta gátját.
Szoptató anyák
A Janumet kombinált összetevőivel nem végeztek vizsgálatokat szoptató állatokban. Az egyes komponensekkel végzett vizsgálatokban mind a szitagliptin, mind a metformin kiválasztódtak a szoptató patkányok tejébe. Nem ismert, hogy a szitagliptin kiválasztódik-e az anyatejbe. Mivel sok gyógyszer kiválasztódik az anyatejbe, a Janumet szoptató nőnek történő beadásakor óvatosan kell eljárni.
Gyermekgyógyászati alkalmazás
A Janumet biztonságosságát és hatékonyságát 18 évesnél fiatalabb gyermekek esetében nem igazolták.
Geriatric használat
Janumetet
Mivel a szitagliptin és a metformin lényegében a vesén keresztül választódik ki, és mivel az öregedés csökkent veseműködéshez vezethet, a Janumet-t óvatosan kell alkalmazni az életkor növekedésével. Óvatosan kell választani az adagot, és a veseműködés gondos és rendszeres ellenőrzésén kell alapulnia. [Lát Figyelmeztetések és óvintézkedések; Klinikai farmakológia.]
A szitagliptin
A szitagliptin II. És III. Fázisában végzett klinikai vizsgálatokban az összes alanyból (N = 3884) 725 beteg volt 65 éves vagy annál idősebb, 61 beteg 75 éves vagy annál idősebb. A biztonságban és a hatékonyságban általános különbségeket nem figyeltek meg a 65 éves vagy annál idősebb és a fiatalabb személyek között. Bár ez és más bejelentett klinikai tapasztalatok nem azonosítottak különbségeket a válaszokban az idős és a fiatalabb betegek között az idősebb egyének nagyobb érzékenysége nem lehet kizárt.
Metformin-hidroklorid
A metformin ellenőrzött klinikai vizsgálatai nem tartalmaztak elegendő számú idős beteget annak meghatározására, hogy eltérően reagálnak-e fiatalabb betegektől, bár más bejelentett klinikai tapasztalatok nem azonosítottak különbségeket az időskorúak és a fiatalok válaszaiban betegek. A metformin csak normál vesefunkciójú betegeknél alkalmazható. A metformin kezdeti és fenntartó adagolásának konzervatívnak kell lennie előrehaladott korú betegek esetében, mivel ebben a populációban csökkent a vesefunkció. Az adag módosításakor a vesefunkció gondos felmérésén kell alapulni. [Lát Ellenjavallatok; Figyelmeztetések és óvintézkedések; és Klinikai farmakológia.]
felső
Overdose
A szitagliptin
Egészséges alanyokkal végzett kontrollált klinikai vizsgálatok során 800 mg-ig egyszeri szitagliptin adagot adtak be. Egy vizsgálatban 800 mg szitagliptin dózis mellett a QTc maximális átlagos növekedését 8,0 ms-tal figyelték meg; ez az átlagos hatás nem tekinthető klinikailag fontosnak [lásd lásd Klinikai farmakológia]. Nem állnak rendelkezésre tapasztalatok a 800 mg feletti dózisok alkalmazásával emberben. Az I. fázisú többdózisú vizsgálatokban nem figyeltek meg dózisfüggő klinikai mellékhatásokat a szitagliptin napi 400 mg-os dózisánál, legfeljebb 28 napos időtartamra.
Túladagolás esetén indokolt a szokásos támogató intézkedéseket alkalmazni, például eltávolítani a felszívhatatlan anyagot a gyomor-bélből. traktuson keresztül, klinikai megfigyelést végezzen (beleértve az elektrokardiogram megszerzését), és indítson támogató terápiát a beteg klinikai jelzése alapján állapot.
A szitagliptin enyhén dializálható. Klinikai vizsgálatokban az adag kb. 13,5% -át eltávolították egy 3–4 órás hemodialízis során. Meghosszabbítható hemodialízis megfontolható, ha klinikai szempontból megfelelő. Nem ismert, hogy a szitagliptin peritoneális dialízissel dializálható-e.
Metformin-hidroklorid
A metformin-hidroklorid túladagolása történt, beleértve az 50 grammot meghaladó mennyiségek lenyelését is. Hipoglikémiáról az esetek kb. 10% -ában számoltak be, de okozati összefüggést a metformin-hidrokloriddal nem állapítottak meg. Tejsavas acidózist jelentettek a metformin túladagolás körülbelül 32% -ánál [lásd Figyelmeztetések és óvintézkedések]. Jó hemodinamikai körülmények között a metformin dializálható akár 170 ml / perc clearance-rel. Ezért a hemodialízis hasznos lehet a felhalmozódott gyógyszer eltávolításához olyan betegektől, akiknél metformin túladagolás gyanúja merül fel.
felső
Leírás
A Janumet (szitagliptin / metformin HCl) tabletta két orális antihiperglikémiás gyógyszert tartalmaz a 2. típusú cukorbetegség kezelésére: szitagliptin és metformin hidroklorid.
A szitagliptin
A szitagliptin a dipeptidil-peptidáz-4 (DPP-4) enzim orálisan aktív inhibitora. A szitagliptin a Janumet tablettákban szitagliptin-foszfát-monohidrát formájában van jelen. A szitagliptin-foszfát-monohidrátot kémiailag 7 - [(3R) - 3-amino-1-oxo-4 - (2,4,5-trifluor-fenil) -butil] - képlettel írják le. 5,6,7,8 - tetrahidro-3 - (trifluor-metil) - 1,2,4 - triazolo [4,3-a] pirazin-foszfát (1: 1) monohidrát empirikus képlettel C16H15F6N5O-H3PO4H2O és molekulatömege 523,32. A szerkezeti képlet:

A szitagliptin-foszfát-monohidrát fehér vagy törtfehér, kristályos, nem higroszkópos por. Vízben és N, N-dimetil-formamidban oldódik; metanolban kissé oldódik; nagyon kevéssé oldódik etanolban, acetonban és acetonitrilben; és izopropanolban és izopropil-acetátban nem oldódik.
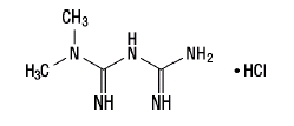
Metformin-hidroklorid
A metformin-hidroklorid (N, N-dimetil-imidikarbonimid-diamid-hidroklorid) kémiai vagy farmakológiai szempontból nem áll rokon az orális antihiperglikémiás szerek bármely más osztályával. A metformin-hidroklorid fehér vagy törtfehér kristályos vegyület, amelynek molekularésze C4H11N5-HCl és molekulatömege 165,63. A metformin-hidroklorid vízben jól oldódik, és acetonban, éterben és kloroformban gyakorlatilag nem oldódik. A pKegy metformin értéke 12,4. A metformin-hidroklorid 1% -os vizes oldatának pH-ja 6,68. A szerkezeti képlet a következő:
Janumetet
A Janumet szájon át történő alkalmazásra 64,25 mg szitagliptin-foszfát-monohidrátot és metformin-hidroklorid-ekvivalenst tartalmazó tabletták formájában kapható. - 50 mg szitagliptin szabad bázis formájában és 500 mg metformin-hidroklorid (Janumet 50 mg / 500 mg) vagy 1000 mg metformin-hidroklorid (Janumet 50 mg / 1000) mg). A Janumet minden filmtabletta a következő inaktív összetevőket tartalmazza: mikrokristályos cellulóz, polivinilpirrolidon, nátrium-lauril-szulfát és nátrium-sztearil-fumarát. Ezenkívül a filmbevonat a következő inaktív összetevőket tartalmazza: polivinil-alkohol, polietilénglikol, talkum, titán-dioxid, vörös vas-oxid és fekete vas-oxid.
felső
Klinikai farmakológia
A cselekvés mechanizmusa
Janumetet
A Janumet két antihiperglikémiás szert és kiegészítő hatásmechanizmust kombinál a glikémiás kontroll javítása érdekében 2. típusú cukorbetegség: szitagliptin, a dipeptidil-peptidáz-4 (DPP-4) gátló, és a metformin-hidroklorid, a biguanid tagja osztály.
A szitagliptin
A szitagliptin egy DPP-4-gátló, amelyről úgy gondolják, hogy 2-es típusú diabéteszben szenvedő betegekben az inkretin hormonok inaktivációjának lelassításával fejti ki hatását. A szitagliptin növeli az aktív ép hormonok koncentrációját, ezáltal növelve és meghosszabbítva ezeknek a hormonoknak a hatását. Inkretin hormonok, beleértve a glükagonszerű peptid-1-et (GLP-1) és a glükóz-függő inzulinotrop szert A polipeptidet (GIP) a bél egész nap felszabadítja, és a válaszok következtében növekszik a szint egy étkezésre. Ezeket a hormonokat a DPP-4 enzim gyorsan inaktiválja. Az inkretin egy endogén rendszer része, amely részt vesz a glükóz homeosztázis fiziológiai szabályozásában. Ha a vércukorszint normális vagy megemelkedett, akkor a GLP-1 és a GIP növeli az inzulinszintézist és a hasnyálmirigy béta-sejtjeiből történő felszabadulást intracelluláris jelátviteli útvonalakkal, beleértve a ciklikus AMP-t. A GLP-1 csökkenti a hasnyálmirigy alfa-sejtekből származó glükagonszekréciót, ami csökkenti a máj glükóztermelését. Az aktív inkretinszintek növelésével és meghosszabbításával a szitagliptin növeli az inzulin felszabadulását és csökkenti a keringés glükagon szintjét glükózfüggő módon. A szitagliptin szelektivitást mutat a DPP-4-rel szemben, és nem gátolja a DPP-8 vagy DPP-9 aktivitását in vitro olyan koncentrációk mellett, amelyek megközelítik a terápiás dózisok koncentrációját.
Metformin-hidroklorid
A metformin antihiperglikémiás szer, amely javítja a glükóztoleranciát 2-es típusú cukorbetegségben szenvedő betegekben, csökkentve az alap- és étkezés utáni plazma glükózszintet. Farmakológiai hatásmechanizmusa különbözik az orális antihiperglikémiás szerek többi osztályától. A metformin csökkenti a máj glükóztermelését, csökkenti a glükóz bélben történő felszívódását és javítja az inzulinérzékenységet azáltal, hogy növeli a perifériás glükózfelvételt és felhasználást. A szulfonilkarbamidokkal ellentétben a metformin nem okoz hipoglikémiát sem 2. típusú cukorbetegségben szenvedő betegekben, sem normál alanyokban (kivéve különleges körülmények között [lásd Figyelmeztetések és óvintézkedések]), és nem okoz hiperinsulinémiát. A metformin-terápiával az inzulin szekréció változatlan marad, miközben az éhgyomri inzulinszint és a napi plazma-inzulinválasz valójában csökkenhet.
12.2 Farmakodinámiák
A szitagliptin
Tábornok
2. típusú cukorbetegségben szenvedő betegeknél a szitagliptin beadása a DPP-4 enzimaktivitás gátlását eredményezte 24 órán keresztül. Orális glükózterhelés vagy étkezés után ez a DPP-4 gátlás az aktív GLP-1 és GIP keringési szintjének 2-3-szorosát növeli, csökkent glükagonkoncentráció és fokozott az inzulin felszabadulása a glükózra, ami magasabb C-peptidet és inzulint eredményez koncentrációk. Az inzulinszint növekedése és a glükagon csökkenése az alacsonyabb éhomi glükózkoncentrációkhoz és a glükózkiürülés csökkenéséhez társult orális glükózterhelés vagy étkezés után.
Szitagliptin és metformin-hidroklorid együttes alkalmazás
Egészséges alanyokkal végzett kétnapos vizsgálatban a szitagliptin önmagában megemelte az aktív GLP-1 koncentrációkat, míg a metformin önmagában megemelte az aktív és az összes GLP-1 koncentrációt hasonló mértékben. A szitagliptin és a metformin együttadása additív hatást gyakorolt az aktív GLP-1 koncentrációkra. A szitagliptin, de a metformin nem növelte az aktív GIP-koncentrációt. Nem világos, mit jelentenek ezek a megállapítások a glikémiás kontroll változásai szempontjából a 2. típusú cukorbetegségben szenvedő betegeknél.
Egészséges alanyokkal végzett vizsgálatokban a szitagliptin nem csökkentette a vércukorszintjét vagy nem okozott hipoglikémiát.
Szív-elektrofiziológia
Egy randomizált, placebo-kontrollos keresztirányú vizsgálatban 79 egészséges alanynak adtak egyszeri 100 mg szitagliptin, 800 mg szitagliptin (az ajánlott adag 8-szorosa) és a placebo egyszeri orális adagját. A javasolt 100 mg-os dózis esetén a plazma csúcskoncentrációnál, illetve a vizsgálat során bármikor nem volt hatással a QTc-intervallumra. A 800 mg-os adagot követően a placebóval korrigált QTc-változás maximális növekedése a kiindulási értékhez képest 3 óra múlva 8,0 ms volt. Ezt a növekedést nem tekintik klinikailag szignifikánsnak. A 800 mg-os dózisnál a szitagliptin csúcskoncentrációja körülbelül 11-szer magasabb volt, mint a 100 mg-os adagot követő csúcskoncentráció.
2-es típusú cukorbetegségben szenvedő betegekben napi 100 mg (N = 81) vagy 200 mg (N = 63) szitagliptin beadása esetén a várható csúcsplazma pillanatában kapott EKG-adatok alapján nem voltak lényeges változások a QTc-intervallumban koncentrációt.
farmakokinetikája
Janumetet
Egészséges alanyokon végzett bioekvivalencia-vizsgálat eredményei kimutatták, hogy a Janumet (szitagliptin / metformin HCl) 50 mg / 500 A mg és 50 mg / 1000 mg kombinációs tabletták bioekvivalensek a megfelelő szitagliptin adagok együttes alkalmazásával (JANUVIA™2) és metformin-hidroklorid különálló tablettákként.
Abszorpció
A szitagliptin
A szitagliptin abszolút biohasznosulása körülbelül 87%. A magas zsírtartalmú étkezés és a szitagliptin együttes adása nem befolyásolta a szitagliptin farmakokinetikáját.
Metformin-hidroklorid
Az 500 mg metformin-hidroklorid tabletta abszolút biohasznosulása éhgyomri körülmények között körülbelül 50-60%. Az 500 mg – 1500 mg és 850–2550 mg közötti metformin-hidroklorid tabletták egyszeri orális dózisát alkalmazó vizsgálatok azt mutatják, hogy a dózis arányosságának hiánya a növekvő dózisoknál, ami inkább a csökkent felszívódásnak, nem pedig az elimináció megváltozásának oka. Az étel csökkenti a metformin felszívódásának mértékét és kissé késlelteti, amit kb. 40% -kal alacsonyabb átlagos plazmacsúcskoncentráció (Cmax), a plazmakoncentráció-görbe (AUC) 25% -kal alacsonyabb területe, és a plazmacsúcs-koncentráció (Tmax) egyetlen 850 mg-os metformintabletta étkezés közben történő bevétele után, összehasonlítva ugyanazzal a tabletta-erősséggel, éhgyomri adaggal. Ezen csökkenések klinikai jelentősége nem ismert.
terjesztés
A szitagliptin
Egészséges alanyok számára a szitagliptin egyszeri 100 mg-os intravénás adagját követően egyensúlyi állapotban az átlagos megoszlási térfogat körülbelül 198 liter. A plazmafehérjékhez reverzibilisen kötődő szitagliptin aránya alacsony (38%).
Metformin-hidroklorid
A metformin látszólagos megoszlási térfogata (V / F) 850 mg metformin-hidroklorid tabletta egyszeri orális adagolása után átlagosan 654 ± 358 l. A metformin elhanyagolható mértékben kötődik a plazmafehérjékhez, szemben a szulfonilkarbamidokkal, amelyek több mint 90% -ban kötődnek fehérjékhez. A metformin megoszlik eritrocitákká, valószínűleg az idő függvényében. A metformin-hidroklorid tabletta szokásos klinikai dózisaival és adagolási ütemtervével a metformin egyensúlyi plazmakoncentrációja 24–48 órán belül eléri és általában
Anyagcsere
A szitagliptin
A szitagliptin körülbelül 79% -a változatlan formában ürül a vizelettel, az anyagcsere csak kis mértékű eliminációs útvonal.
Után a14C] szitagliptin orális dózis, a radioaktivitás kb. 16% -a ürült a szitagliptin metabolitjaként. Hat metabolitot detektáltak nyomakon, és várhatóan nem járulnak hozzá a szitagliptin plazma DPP-4 gátló aktivitásához. In vitro vizsgálatok azt mutatták, hogy a szitagliptin korlátozott metabolizmusáért felelős elsődleges enzim a CYP3A4 volt, a CYP2C8 hozzájárulásával.
Metformin-hidroklorid
Normál alanyokon belüli, egyszeri adaggal végzett intravénás vizsgálatok azt mutatják, hogy a metformin változatlan formában ürül a betegségben vizelettel jár, és nem megy keresztül máj metabolizmusába (az emberben metabolitot nem azonosítottak) és az epebe sem kiválasztás.
Kiválasztás
A szitagliptin
Orális beadást követően [14C] szitagliptin dózis egészséges alanyoknál, a beadott radioaktivitás kb. 100% -a ürült ki széklettel (13%) vagy vizelettel (87%) az adagolást követő egy héten belül. A látszólagos terminál t1/2 a 100 mg-os szitagliptin orális adag bevétele után körülbelül 12,4 óra volt, és a renális clearance körülbelül 350 ml / perc volt.
A szitagliptin elsősorban a vesén keresztül ürül, és aktív tubuláris szekrécióval jár. A szitagliptin az emberi szerves anion transzporter-3 (hOAT-3) szubsztrátja, amely részt vehet a szitagliptin renalis eliminációjában. A hOAT-3 klinikai jelentőségét a szitagliptin szállításában nem igazolták. A szitagliptin a p-glikoprotein szubsztrátja is, amely szintén részt vehet a szitagliptin renalis eliminációjának közvetítésében. A p-glikoprotein-gátló ciklosporin azonban nem csökkentette a szitagliptin renalis clearance-ét.
Metformin-hidroklorid
A vese clearance körülbelül 3,5-szer nagyobb, mint a kreatinin-clearance, ami azt jelzi, hogy a tubuláris szekréció a metformin eliminációjának fő útja. Orális beadást követően a felszívódott gyógyszer kb. 90% -a vesén keresztül eliminálódik az első 24 óra alatt, a plazma eliminációs felezési ideje körülbelül 6,2 óra. A vérben az eliminációs felezési idő körülbelül 17,6 óra, ami arra utal, hogy az eritrociták tömege lehet az eloszlási rekesz.
Különleges populációk
Veseelégtelenség
Janumetet
A Janumet nem alkalmazható veseelégtelenségben szenvedő betegekben [lásd Ellenjavallatok; Figyelmeztetések és óvintézkedések].
A szitagliptin
Közepesen veseelégtelenségben a szitagliptin plazma AUC plazma AUC-értékének kb. növekedést figyeltünk meg súlyos veseelégtelenségben szenvedő betegekben, ideértve a hemodializált ESRD-s betegeket is, a normál egészséges kontrollhoz képest alanyok.
Metformin-hidroklorid
Csökkent vesefunkciójú betegekben (a mért kreatinin-clearance alapján) a plazma és a vér felezési ideje A metformin hatása meghosszabbodik, és a vese clearance csökken a kreatinin csökkenésével arányosan távolság.
Májelégtelenség
A szitagliptin
Mérsékelt májelégtelenségben (Child-Pugh pontszám 7–9) szenvedő betegekben az átlagos AUC és Cmax A szitagliptin adagja körülbelül 21% -kal, illetve 13% -kal nőtt az egészséges kontroll csoporthoz viszonyítva, amikor a szitagliptin egyszeri 100 mg-os adagját beadták. Ezeket a különbségeket nem tekintik klinikailag jelentősnek.
Súlyos májelégtelenségben (Child-Pugh pontszám> 9) nincs klinikai tapasztalat.
Metformin-hidroklorid
Májelégtelenségben nem végeztek metformin farmakokinetikai vizsgálatokat.
nem
A szitagliptin
A nemnek nincs kompozit alapján klinikailag jelentős hatása a szitagliptin farmakokinetikájára az I. fázis farmakokinetikai adatainak elemzése, valamint az I. és a II. fázis populációs farmakokinetikai elemzése adat.
Metformin-hidroklorid
A metformin farmakokinetikai paraméterei nem nem különböztek szignifikánsan a normális alanyok és a 2. típusú cukorbetegségben szenvedő betegek között a nemek szerinti elemzés során. Hasonlóképpen, kontrollált klinikai vizsgálatokban 2-es típusú cukorbetegségben szenvedő betegekben a metformin antihiperglikémiás hatása hasonló volt férfiakban és nőkben.
Időskori
A szitagliptin
Amikor figyelembe vesszük az életkor veseműködésre gyakorolt hatásait, önmagában az életkornak nincs klinikailag megfelelő adatai a szitagliptin farmakokinetikájára gyakorolt jelentős hatás a populáció farmakokinetikája alapján elemzés. Idős személyeknél (65-80 év) a szitagliptin plazmakoncentrációja körülbelül 19% -kal magasabb, mint a fiatalabb személyeknél.
Metformin-hidroklorid
Egészséges idős betegekben a metformin kontrollált farmakokinetikai vizsgálatainak korlátozott száma arra utal, hogy a metformin teljes plazma clearance-e csökken, a felezési idő meghosszabbodik, és a Cmax nő az egészséges fiatal alanyokhoz viszonyítva. Ezen adatok alapján úgy tűnik, hogy a metformin farmakokinetikájának az öregedéssel járó változását elsősorban a vesefunkció megváltozása okozza (lásd GLUCOPHAGE3 felírási információk: KLINIKAI FARMAKOLÓGIA, Speciális populációk, Geriatrika).
A Janumet-kezelést csak 80 éves betegekben szabad elkezdeni, kivéve, ha a kreatinin-clearance mérése azt mutatja, hogy a vesefunkció nem csökken Figyelmeztetések és óvintézkedések].
gyermekgyógyászati
Gyermekkori betegekben nem végeztek vizsgálatokat a Janumet-rel.
Verseny
A szitagliptin
Összetett elemzés alapján a fajnak nem volt klinikailag jelentős hatása a szitagliptin farmakokinetikájára a rendelkezésre álló farmakokinetikai adatok, beleértve a fehér, spanyol, fekete, ázsiai és egyéb faji személyeket csoportokat.
Metformin-hidroklorid
A metformin farmakokinetikai paramétereit faj szerint nem végeztek. A metformin kontrollos klinikai vizsgálataiban 2-es típusú cukorbetegekben az antihiperglikémiás hatás hasonló volt a fehérekben (n = 249), a feketékben (n = 51) és a spanyolokban (n = 24).
Testtömeg-index (BMI)
A szitagliptin
A testtömeg-indexnek nem volt klinikailag jelentős hatása a szitagliptin farmakokinetikájára egy kompozit alapján az I. fázis farmakokinetikai adatainak elemzése, valamint az I. és a II. fázis populációs farmakokinetikai elemzése adat.
Gyógyszerkölcsönhatások
Szitagliptin és metformin-hidroklorid
A szitagliptin (50 mg) és a metformin (1000 mg) többszöri adagjának egyidejű beadása naponta kétszer történt nem befolyásolja jelentősen a szitagliptin vagy a metformin farmakokinetikáját 2. típusú betegek esetén cukorbetegség.
A Janumet-rel nem végeztek farmakokinetikai gyógyszerkölcsönhatási vizsgálatokat; ilyen vizsgálatokat azonban a Janumet egyes összetevőivel (szitagliptin és metformin-hidroklorid) végeztek.
A szitagliptin
A gyógyszerkölcsönhatások in vitro értékelése
A szitagliptin nem gátolja a CYP3A4, 2C8, 2C9, 2D6, 1A2, 2C19 vagy 2B6 CYP izoenzimeket, és nem indukálja a CYP3A4. A szitagliptin p-glikoprotein szubsztrát, de nem gátolja a digoxin p-glikoprotein által közvetített transzportját. Ezen eredmények alapján a szitagliptin valószínűtlen, hogy kölcsönhatásba lép más gyógyszerekkel, amelyek ezeket az útvonalakat használják.
A szitagliptin nem kötődik nagymértékben a plazmafehérjékhez. Ezért nagyon kevés a szitagliptin hajlama a plazmafehérje-kötődés elmozdulása által közvetített klinikailag jelentős gyógyszer-gyógyszerkölcsönhatásokba való bevonásra.
A gyógyszerkölcsönhatások in vivo értékelése
A szitagliptin hatása más gyógyszerekre
Az alábbiakban ismertetett klinikai vizsgálatokban a szitagliptin nem változtatta meg jelentősen a metformin, a glicurid, a szimvasztatin, a rosiglitazon, a warfarin vagy az orális gyógyszer farmakokinetikáját. fogamzásgátlók, amelyek in vivo bizonyítékot szolgáltatnak a csekély hajlamosságra a CYP3A4, CYP2C8, CYP2C9 szubsztrátokkal és szerves kationos transzporterrel történő kölcsönhatások kiváltására (OKTÓBER).
Digoxin: A szitagliptin minimális hatással volt a digoxin farmakokinetikájára. 0,25 mg digoxin és 100 mg szitagliptin együttes adagolása után 10 napig, a digoxin plazma AUC-je 11% -kal nőtt, a Cmax 18% -kal.
Szulfonilkarbamidok: A CYP2C9 szubsztrát glicurid egydózisú farmakokinetikája nem változott jelentősen azoknál a betegeknél, akik többszörös szitagliptin adagot kaptak. Klinikailag jelentős kölcsönhatások nem várhatók más szulfonil-karbamidokkal (például glipiziddel, tolbutamiddal és glimepiriddel), amelyeket, hasonlóan a gluturidhoz, elsősorban a CYP2C9 eliminál. Figyelmeztetések és óvintézkedések].
Szimvasztatin: A CYP3A4 szubsztrát, a szimvasztatin egyadagos farmakokinetikája nem változott jelentősen azoknál a betegeknél, akik többszörös napi szitagliptin-kezelést kaptak. Ezért a szitagliptin nem gátolja a CYP3A4 által közvetített anyagcserét.
Tiazolidindionok: A rosiglitazon egyszeri dózisú farmakokinetikája nem változott jelentősen az egyénekben többszörös napi adag szitagliptin kapása, jelezve, hogy a szitagliptin nem gátolja a CYP2C8-mediált anyagcsere.
Warfarin: A szitagliptin több napi adagja nem változtatta meg jelentősen a farmakokinetikát, a S (-) vagy R (+) warfarin enantiomerek vagy farmakodinámiája (a protrombin INR mérésével becsülve) egy adag warfarin. Mivel az S (-) warfarint elsősorban a CYP2C9 metabolizálja, ezek az adatok alátámasztják azt a következtetést is, hogy a szitagliptin nem CYP2C9 inhibitor.
Orális fogamzásgátlók: A szitaglipinnel történő egyidejű alkalmazás nem befolyásolta jelentősen a norethindron vagy az etinil-ösztradiol egyensúlyi állapotú farmakokinetikáját.
Egyéb gyógyszerek hatása a szitagliptinre
Az alábbiakban ismertetett klinikai adatok arra utalnak, hogy a szitagliptin nem érzékeny az együttesen alkalmazott gyógyszerek klinikailag jelentős kölcsönhatásokra.
Ciklosporin: Vizsgáltunk egy ciklosporinnak, amely egy p-glikoprotein hatékony gátló hatása a szitagliptin farmakokinetikájára. A szitagliptin egyszeri 100 mg-os orális adagjának és a egyszeri 600 mg-os ciklosporin orális adagjának együttes alkalmazása növeli az AUC és Cmax szitagliptin aránya körülbelül 29% -kal, illetve 68% -kal. A szitagliptin farmakokinetikájának ezeket a szerény változásokat nem tekintették klinikai szempontból jelentősnek. A szitagliptin renalis clearance-e szintén nem változott jelentősen. Ezért más p-glikoprotein inhibitorokkal nem várható jelentős kölcsönhatás.
Metformin-hidroklorid
[Lát Gyógyszerkölcsönhatások]
felső
Nem klinikai toxikológia
Karcinogenezis, mutagenezis, termékenységi romlás
Janumetet
A Janumet-ben a kombinált termékekkel nem végeztek állatkísérleteket a karcinogenezis, a mutagenezis vagy a termékenység romlásának értékelésére. A következő adatok a szitagliptin és a metformin külön-külön végzett vizsgálatain alapulnak.
A szitagliptin
Két éves karcinogenitási vizsgálatot végeztünk hím és nőstény patkányokon, szitagliptin orális adagjaként 50, 150 és 500 mg / kg / nap. A kombinált máj adenoma / karcinóma előfordulása nőtt férfiaknál és nőknél, valamint a máj karcinóma nőknél 500 mg / kg adag mellett. Ez az adag az AUC összehasonlítás alapján a humán expozíció körülbelül 60-szorosainak teszi ki a maximális ajánlott napi felnőtt ember-dózis (MRHD) 100 mg / nap értékét. A májdaganatokat nem figyelték meg 150 mg / kg adag mellett, ami körülbelül 20-szorosa volt az emberi expozíciónak az MRHD-nél. Kétéves karcinogenitási vizsgálatot végeztünk hím és nőstény egerekben, szitagliptin szájon át 50, 125, 250 és 500 mg / kg / nap dózisban. Semmilyen szervben a daganatok előfordulásának növekedése 500 mg / kg-ig nem növekedett, ami körülbelül 70-szerese az emberi expozíciónak az MRHD-nél. A szitagliptin nem volt mutagén vagy klastogén metabolikus aktiválással vagy anélkül az Ames baktérium mutagenitási vizsgálatban, egy kínai hörcsög petefészekben (CHO) kromoszóma-rendellenesség-vizsgálat, in vitro citogenetikai vizsgálat CHO-ban, in vitro patkány hepatocita-DNS lúgos elúciós vizsgálat és in vivo mikronukleusz próba.
Patkányok termékenységi vizsgálatában 125, 250 és 1000 mg / kg dózisú orális adagolással a hímeket 4 hétig kezelték a párzás előtt, a párzás, a tervezett befejezésig (összesen körülbelül 8 hét), és a nőstényeket 2 héttel a párzás előtt kezelték a terhesség során 7. nap 125 mg / kg adag mellett nem figyeltek meg káros hatást a termékenységre (az AUC összehasonlítások alapján az emberi expozíció körülbelül tizenötszörösére nő a napi 100 mg MRHD esetén). Nagyobb dózisoknál a nondózistól függő megnövekedett resorpciókat figyelték meg nőkben (az AUC összehasonlítás alapján az MRHD körülbelül az ember expozíciójának körülbelül 25-szeresére és 100-szorosara).
Metformin-hidroklorid
Hosszú távú karcinogenitási vizsgálatokat végeztek patkányokban (az adagolás időtartama 104 hét) és egerekben (az adagolás időtartama 91 hét) legfeljebb 900 mg / kg / nap és 1500 mg / kg / nap dózisokig, illetőleg. Ezek a dózisok egyaránt a testfelület összehasonlításai alapján megközelítőleg a humán napi 2000 mg maximális ajánlott napi dózisának körülbelül négyszeresét teszik ki. Sem a hím, sem a nőstény egerekben nem találtak bizonyítékot a metformin karcinogenitására. Hasonlóképpen, hím patkányokban nem volt megfigyelhető daganatos hatás. Naponta 900 mg / kg-os kezelt nőstény patkányokban azonban növekedett a jóindulatú stroma méhpolipok előfordulása.
A következő in vitro tesztekben nem volt bizonyíték a metformin mutagén képességére: Ames-teszt (S. typhimurium), génmutációs teszt (egér limfóma sejtek) vagy kromoszóma aberrációs teszt (humán limfociták). Az in vivo egér mikronukleusz-teszt eredményei szintén negatívak voltak. A hím vagy nőstény patkányok termékenységét nem befolyásolta a metformin, ha napi 600 mg / kg dózisban adták be őket, amely a testfelület alapján körülbelül háromszorosa az ember számára javasolt maximális napi dózisnak összehasonlítások.
felső
Klinikai vizsgálatok
A szitagliptin és a metformin együttes alkalmazását tanulmányozták 2-es típusú cukorbetegségben szenvedő betegekben, akiknek étrendje és testmozgása nem megfelelő volt, és glimepiriddel kombinálva.
A Janumet-rel nem végeztek klinikai hatékonysági vizsgálatokat; kimutatták a Janumet bioekvivalenciáját az együttadott szitagliptin és metformin-hidroklorid tablettákkal.
Szitagliptin és metformin együttes alkalmazás a 2. típusú cukorbetegségben szenvedő betegek esetén, akik étrend és testmozgás során nem megfelelőek
Összesen 1091 2-es típusú cukorbetegségben szenvedő beteg, akiknek étrendje és testmozgása nem megfelelő a glikémiás szabályozásban, részt vettek egy 24 hetes, randomizált, kettős vak, placebo-kontrollos faktorialis vizsgálat a szitagliptin és a metformin hatékonyságának felmérésére együttes alkalmazás. Az antihiperglikémiás szerekkel (N = 541) kezelt betegek diétán, testgyakorláson és gyógyszeres mosáson mentek keresztül, legfeljebb 12 hetes időtartamra. A kimosódási periódus után a nem megfelelő glikémiás kontrollban szenvedő betegeket (A1C 7,5% - 11%) randomizálták egy 2 hetes, egyszeri vak, placebo bevezetési időszak elvégzése után. Betegek, akik nem vesznek részt hiperglikémiás szerekkel a vizsgálat megkezdésekor (N = 550), nem megfelelő glikémiás kontroll (A1C 7,5% -ról 11% -ra) azonnal belépett a 2-hetes egyvak vakbuborékba való bejutási periódusába, majd az volt véletlenszerűsített. Körülbelül azonos számú beteget randomizáltak placebót, napi egyszeri 100 mg szitagliptin, 500 mg vagy 1000 adagot kapni. napi kétszer mg metformin, vagy napi kétszer 50 mg szitagliptin 500 mg vagy 1000 mg metformin kétszer kombinálva napi. Azokat a betegeket, akiknek a vizsgálat alatt nem sikerült elérniük a specifikus glikémiás célokat, glicuriddal (glibenklamid) kezelték.
A szitagliptin és a metformin együttes adagolása szignifikáns javulást eredményezett az A1C, az FPG és a 2 órás PPG összehasonlításában a placebo, csak a metformin és a szitagliptin önmagában összehasonlításában (3. táblázat, 1. ábra). Az A1C-ben a kiindulási értékhez viszonyított átlagos csökkenés általában nagyobb volt azoknál a betegeknél, akiknél a kiindulási A1C-érték magasabb. Azoknál a betegeknél, akiknél a vizsgálat megkezdésekor nem alkalmaztak antihiperglikémiás szert, az A1C átlagos csökkenése a kiindulási értékhez képest: szitagliptin napi egyszeri 100 mg, -1,1%; metformin 500 mg kétszer, -1,1%; 1000 mg metformin kétszer, -1,2%; 50 mg szitagliptin kétszer 500 mg metforminnal kétszer, -1,6%; 50 mg szitagliptin kétszer, metformin 1000 mg kétszer, 1,9%; és a placebót kapó betegek esetében -0,2%. A lipid hatása általában semleges volt. A szitagliptin és metformin kombinációjával kezelt csoportokban a testtömeg csökkenése hasonló volt, mint azokban a csoportokban, amelyeket metformin önmagában vagy placebóval kaptak.
3. táblázat: Glikémiás paraméterek a végső látogatáson (24 hetes vizsgálat) a szitagliptin és a metformin önmagában és kombinációjában a 2. típusú cukorbetegségben szenvedő betegeknél, akik étrend és testmozgás során nem megfelelőek *
Placebo |
A szitagliptin 100 mg QD |
metformin 500 mg / nap |
metformin 1000 mg / nap |
A szitagliptin 50 mg / nap metformin 500 mg / nap |
A szitagliptin 50 mg / nap metformin 1000 mg / nap |
|
| ||||||
| A1C (%) | N = 165 | N = 175 | N = 178 | N = 177 | N = 183 | N = 178 |
| Alapvonal (átlag) | 8.7 | 8.9 | 8.9 | 8.7 | 8.8 | 8.8 |
| Változás a kiindulási értékhez képest (korrigált átlag†) | 0.2 | -0.7 | -0.8 | -1.1 | -1.4 | -1.9 |
| Különbség a placebótól (korrigált átlag)†) (95% CI) |
-0.8c (-1.1, -0.6) |
-1.0c (-1.2, -0.8) |
-1.3c (-1.5, -1.1) |
-1.6c (-1.8, -1.3) |
-2.1c (-2.3, -1.8) |
|
| Betegek (%), akiknél az A1C <7% | 15 (9%) | 35 (20%) | 41 (23%) | 68 (38%) | 79 (43%) | 118 (66%) |
| % Mentő gyógyszeres kezelésben részesülő betegek | 32 | 21 | 17 | 12 | 8 | 2 |
| FPG (mg / dL) | N = 169 | N = 178 | N = 179 | N = 179 | N = 183 | N = 180 |
| Alapvonal (átlag) | 196 | 201 | 205 | 197 | 204 | 197 |
| Változás a kiindulási értékhez képest (korrigált átlag†) | 6 | -17 | -27 | -29 | -47 | -64 |
| Különbség a placebótól (korrigált átlag)†) (95% CI) |
-23c (-33, -14) |
-33c (-43, -24) |
-35c (-45, -26) |
-53c (-62, -43) |
-70c (-79, -60) |
|
| 2 órás PPG (mg / dL) | N = 129 | N = 136 | N = 141 | N = 138 | N = 147 | N = 152 |
| Alapvonal (átlag) | 277 | 285 | 293 | 283 | 292 | 287 |
| Változás a kiindulási értékhez képest (korrigált átlag†) | 0 | -52 | -53 | -78 | -93 | -117 |
| Különbség a placebótól (korrigált átlag)†) (95% CI) |
-52c (-67, -37) |
-54c (-69, -39) |
-78c (-93, -63) |
-93c (-107, -78) |
-117c (-131, -102) |
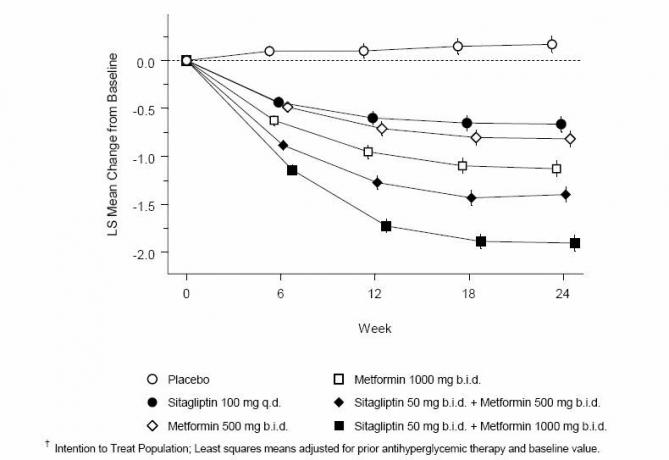
1. ábra: Az A1C átlagos változása a kiindulási értékhez képest (%) 24 hét alatt, szitagliptin és önmagában metformin felhasználásával és kombinációban a 2-es típusú cukorbetegségben szenvedő betegek esetén, akik étrenddel és testmozgással nem megfelelőek
Ezenkívül a vizsgálatba bevont betegek (N = 117) súlyosabb hiperglikémiában szenvedtek (A1C> 11% vagy vér) glükóz> 280 mg / dL), akiket naponta kétszer 50 mg szitagliptin és metformin 1000 kezeléssel kezeltek mg. Ebben a betegcsoportban az átlagos kiindulási A1C érték 11,2% volt, az átlagos FPG 314 mg / dl, az átlagos 2 órás PPG pedig 441 mg / dL. 24 hét után megfigyelték az átlagos kiindulási értékhez viszonyított -2,9% -os csökkenést A1C esetén, -127 mg / dl az FPG és -208 mg / dL 2 órás PPG esetén.
A kezdeti kombinációs terápiát vagy a kombinált terápia fenntartását egyedileg kell meghatározni, és az egészségügyi szolgáltató mérlegelési jogkörébe kell hagyni.
Szitagliptin-kiegészítő kezelés 2-es típusú cukorbetegségben szenvedő betegeknél, akik önmagában nem kielégítően ellenőrzött
Összesen 701 2. típusú diabéteszes beteg vett részt egy 24 hetes randomizált, kettős vak, placebo-kontrollos vizsgálatban, amelynek célja a szitagliptin és a metformin kombinációjának hatékonyságának felmérése. Azokat a betegeket, akik már metforminnal (N = 431) kaptak napi legalább 1500 mg dózisban, randomizáltuk a kéthetes, egyszeri vak, placebo bevezetési periódus elvégzése után. Metforminnal és más antihiperglikémiás szerekkel (N = 229) kezelt betegek, valamint antihiperglikémiás szerek nélkül nem részesülő betegek (terápián kívül legalább 8 hetek, N = 41) körülbelül 10 hetes bejáratási periódust követően randomizáltak metforminnal (napi legalább 1500 mg dózis mellett) monoterápia. A betegeket randomizáltuk 100 mg szitagliptin vagy placebo hozzáadásával, naponta egyszer adva. Azokat a betegeket, akiknek a vizsgálatok során nem sikerült elérniük a specifikus glikémiás célokat, pioglitazon-mentéssel kezeltük.
A metforminnal kombinálva a szitagliptin szignifikáns javulást eredményezett az A1C, az FPG és a 2 órás PPG-ben, összehasonlítva a metforminnal kezelt placebóval (4. táblázat). A mentő glikémiás terápiát a 100 mg szitagliptin kezelésben részesülő betegek 5% -ában, a placebóval kezelt betegek 14% -ában alkalmazták. A testtömeg hasonló csökkenését figyelték meg mindkét kezelési csoportban.
4. táblázat: Glikémiás paraméterek a szitagliptin záró látogatása során (24 hetes tanulmány) a metforminnal történő kiegészítő kombinációs terápiában *
| 100 mg szitagliptin QD + Metformin |
Placebo + Metformin |
|
| ||
| A1C (%) | N = 453 | N = 224 |
| Alapvonal (átlag) | 8.0 | 8.0 |
| Változás a kiindulási értékhez képest (korrigált átlag†) | -0.7 | -0.0 |
| Különbség a placebo + metforminhoz képest (korrigált átlag)†) (95% CI) |
-0.7c (-0.8, -0.5) |
|
| Betegek (%), akiknél az A1C <7% | 213 (47%) | 41 (18%) |
| FPG (mg / dL) | N = 454 | N = 226 |
| Alapvonal (átlag) | 170 | 174 |
| Változás a kiindulási értékhez képest (korrigált átlag†) | -17 | 9 |
| Különbség a placebo + metforminhoz képest (korrigált átlag)†) (95% CI) |
-25c (-31, -20) |
|
| 2 órás PPG (mg / dL) | N = 387 | N = 182 |
| Alapvonal (átlag) | 275 | 272 |
| Változás a kiindulási értékhez képest (korrigált átlag†) | -62 | -11 |
| Különbség a placebo + metforminhoz képest (korrigált átlag)†) (95% CI) |
-51c (-61, -41) |
Szitagliptin-kiegészítő kezelés 2-es típusú cukorbetegségben szenvedő betegeknél, akiknek metformin és glimepirid kombinációja nem megfelelő.
Összesen 441 2. típusú diabéteszes beteg vett részt egy 24 hetes, randomizált, kettős vak, placebo-kontrollos vizsgálat, amelynek célja a szitagliptin glimepiriddel kombinációban, vagy azzal történő hatékonyságának felmérése metformin nélkül. A betegek egy beindítási kezelési periódust csak glimepiriddel (â mg 4 mg / nap) önmagában vagy glimepiriddel és metforminnal kombinálva (¥ ‰ ¥ 1500 mg naponta) alkalmaztak. Dózis-titrálást és dózistabilis bejutási periódust akár 16 hétig, valamint egy 2 hetes placebo beadási periódust követően a nem megfelelő betegek a glikémiás kontrollt (A1C 7,5% –10,5%) randomizáltuk 100 mg szitagliptin vagy placebo hozzáadásával, amelyet egyszer adtak be napi. Azokat a betegeket, akiknek a vizsgálatok során nem sikerült elérniük a specifikus glikémiás célokat, pioglitazon-mentéssel kezeltük.
A szitagliptin metforminnal és glimepiriddel kezelt betegek szignifikáns javulást mutattak az A1C és az FPG-ben, összehasonlítva azokkal, akik placebo metforminnal és glimepiriddel (5. táblázat), az alapszinthez viszonyítva az átlagos szintetől a placebóhoz viszonyítva -0,9% az A1C-ben és a -21 FPG-ben mg / dl. A mentési terápiát a 100 mg szitagliptinnel kezelt betegek 8% -ánál, a kiegészítő placebóval kezelt betegek 29% -ánál alkalmazták. A szitagliptin-kiegészítővel kezelt betegek átlagos testsúlynövekedése 1,1 kg volt, kiegészítő placebo (+0,4 kg vs. -0,7 kg). Ezenkívül a szitagliptin kiegészítése megnövekedett hypoglykaemia arányt eredményezett a kiegészítő placebóhoz képest. [Lát Figyelmeztetések és óvintézkedések; Mellékhatások.]
5. táblázat: Glikémiás paraméterek a végső látogatás során (24 hetes tanulmány) a szitagliptinhez metforminnal és glimepiriddel kombinálva *
| 100 mg szitagliptin + Metformin és glimepirid |
Placebo + Metformin és glimepirid |
|
| ||
| A1C (%) | N = 115 | N = 105 |
| Alapvonal (átlag) | 8.3 | 8.3 |
| Változás a kiindulási értékhez képest (korrigált átlag†) | -0.6 | 0.3 |
| Különbség a placebótól (korrigált átlag)†) (95% CI) | -0.9c (-1.1, -0.7) |
|
| Betegek (%), akiknél az A1C <7% | 26 (23%) | 1 (1%) |
| FPG (mg / dL) | N = 115 | N = 109 |
| Alapvonal (átlag) | 179 | 179 |
| Változás a kiindulási értékhez képest (korrigált átlag†) | -8 | 13 |
| Különbség a placebótól (korrigált átlag)†) (95% CI) | -21c (-32, -10) |
Szitagliptin kiegészítő terápia vs. Glipizid kiegészítő kezelés 2-es típusú cukorbetegségben szenvedő betegeknél, akik nem kielégítően ellenőrizték a metformin kezelését
A szitagliptin hatékonyságát 52 hetes, kettős-vak, glipizid-vezérelt nonferority vizsgálatban értékelték 2-es típusú cukorbetegekben. A nem kezelt vagy más vérnyomáscsökkentő szerekkel nem kezelt betegek egy 12 hetes bejáratási periódusba léptek metformin monoterápiával (napi 1500 mg dózis), amely magában foglalta a metformin kivételével más gyógyszerek kimerítését is, alkalmazható. A bejáratási periódus után azokat a betegeket, akiknek nem volt megfelelő a glikémiás szabályozása (A1C 6,5% és 10%), randomizáltuk 1: 1 arányban a napi egyszeri 100 mg szitagliptin vagy a glipizid 52 héten át történő adagolása céljából. A glipizid kezelésben részesülő betegek kezdeti napi 5 mg-os dózisát kapják, majd a következő 18 hét során elektíven titrálják, a napi 20 mg-os maximális dózisig, a glikémiás kontroll optimalizálása érdekében. Ezt követően a glipizid adagját állandó értéken kell tartani, kivéve a titrálást a hipoglikémia megelőzése érdekében. A titrálás után a glipizid átlagos dózisa 10 mg volt.
52 hét elteltével a szitagliptin és a glipizid hasonló mértékű csökkenést mutatott az alapszinthez képest az A1C-ben a kezelési szándék elemzése során (6. táblázat). Ezek az eredmények összhangban álltak a protokollonkénti elemzéssel (2. ábra). A szitagliptin és a glipizid közötti nem alsóbbrendűségre vonatkozó következtetés az alaphelyzetben lévő betegekre korlátozódhat. Az A1C összehasonlítható a vizsgálatban szereplőkkel (a betegek több mint 70% -ánál a kiindulási A1C <8% volt, és több mint 90% -nál A1C <9%).
6. táblázat: Glikémiás paraméterek egy 52 hetes vizsgálatban, amelyben a szitagliptin és a glipizid összehasonlítása kiegészítő terápiával kezelt betegek körében nem kielégítően szabályozott a metformin (kezelésre szánt populáció) *
| 100 mg szitagliptin + Metformin |
glipizid + Metformin |
|
| ||
| A1C (%) | N = 576 | N = 559 |
| Alapvonal (átlag) | 7.7 | 7.6 |
| Változás a kiindulási értékhez képest (korrigált átlag†) | -0.5 | -0.6 |
| FPG (mg / dL) | N = 583 | N = 568 |
| Alapvonal (átlag) | 166 | 164 |
| Változás a kiindulási értékhez képest (korrigált átlag†) | -8 | -8 |
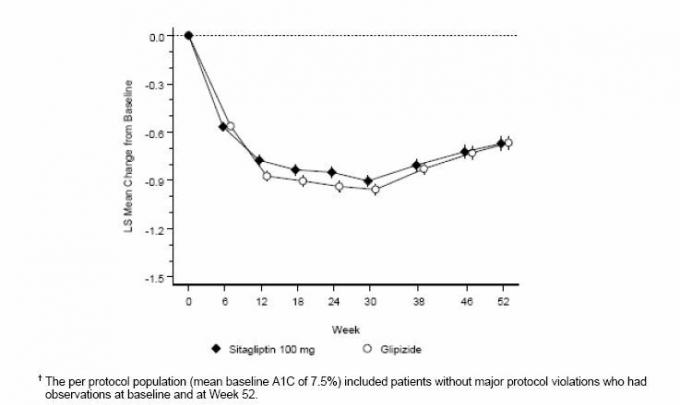
2. ábra: Az A1C átlagos változása az alapszinthez viszonyítva (%) 52 heten át egy olyan vizsgálatban, amelyben a szitagliptin és a Glipizid kiegészítő kezelésként olyan betegek esetén, akik nem kielégítően kontrolláltak a metforminon (protokollonként) â€
A hipoglikémia előfordulása a szitagliptin csoportban (4,9%) szignifikánsan (p <0,001) alacsonyabb volt, mint a glipizid csoportban (32,0%). A szitagliptinnel kezelt betegekben a testtömeg szignifikáns átlagos csökkenése volt a kiindulási értékhez képest, összehasonlítva a glipiziddel kezelt betegek szignifikáns súlygyarapodásával (-1,5 kg vs. +1,1 kg).
felső
Hogyan szállították
6747 számú tabletta - A Janumet 50 mg / 500 mg tabletta halvány rózsaszínű, kapszula alakú, filmbevonatú tabletta, egyik oldalán "575" jelöléssel ellátva. Ezeket a következőképpen szállítják:
NDC 0006-0575-61 60 egység használatos üveg
NDC 0006-0575-62 180 egység felhasználható üveg
NDC 0006-0575-52 egységdózis buborékcsomagolás, 50 darab
NDC 0006-0575-82 1000 ömlesztett palack.
6749 szám - A Janumet 50 mg / 1000 mg tabletta piros, kapszula alakú, filmbevonatú tabletta, egyik oldalán "577" jelöléssel ellátva. Ezeket a következőképpen szállítják:
NDC 0006-0577-61 60 egység használatos üveg
NDC 0006-0577-62 180 egység felhasználható üveg
NDC 0006-0577-52 egységdózis buborékcsomagolás, 50 darab
NDC 0006-0577-82 1000 ömlesztett palack.
20-25 ° C (68-77 ° F) hőmérsékleten tárolandó, az eltérések megengedettek 15-30 ° C-ra (59-86 ° F).
felső
Információ a betegek tanácsadásáról
Utasítás
A betegeket tájékoztatni kell a Janumet lehetséges kockázatairól és előnyeiről, valamint az alternatív terápiás módokról. Tájékoztatni kell őket az étrendi előírások betartásának, a rendszeres testmozgás, az időszakos vér fontosságáról is glükóz monitorozás és A1C tesztelés, hypoglykaemia és hiperglikémia felismerése és kezelése, valamint a cukorbetegség értékelése komplikációk. A stressz olyan időszakaiban, mint például láz, trauma, fertőzés vagy műtét, a gyógyszeres kezelés igényei változhatnak, és a betegeket tanácsolni kell, hogy haladéktalanul forduljanak orvoshoz.
A tejsavas acidózis kockázata a metformin-összetevő, annak tünetei és a fejlődésre hajlamos körülmények miatt, amint azt a Figyelmeztetések és óvintézkedések, meg kell magyarázni a betegek számára. A betegeket figyelmeztetni kell a Janumet azonnali abbahagyására és haladéktalanul értesíteni orvosát, ha megmagyarázhatatlan hiperventiláció, mialgia, rossz közérzet, szokatlan aluszékonyság, szédülés, lassú vagy szabálytalan szívverés, hideg érzés (különösen a végtagokban) vagy egyéb nem specifikus tünetek előfordul. A gyomor-bélrendszeri tünetek gyakoriak a metformin-kezelés megkezdésekor, és előfordulhatnak a Janumet-kezelés megkezdésekor; a betegeknek azonban konzultálniuk kell orvosukkal, ha megmagyarázhatatlan tünetek merülnek fel. Bár a gastrointestinalis tünetek, amelyek a stabilizáció után fordulnak elő, valószínűtlen, hogy gyógyszerfüggőek, ilyenek a tünetek előfordulását ki kell értékelni annak meghatározása érdekében, hogy az oka lehet-e tejsavas acidózis vagy más súlyos betegség.
A Janumet-kezelés alatt a betegeket figyelmeztetni kell az akut vagy krónikus túlzott alkoholfogyasztásra.
A betegeket tájékoztatni kell a vesefunkció és a hematológiai paraméterek rendszeres tesztelésének fontosságáról a Janumet-kezelés alatt.
A betegeket tájékoztatni kell arról, hogy allergiás reakciókról számoltak be a forgalomba hozatalt követő szitagliptin, a Janumet egyik alkotóelemének használata során. Ha allergiás reakciók tünetei (beleértve a kiütést, csalánkiütéset, valamint az arc, az ajkak, a nyelv és a torok duzzanatát) légzési vagy nyelési nehézségeket okozhat), a betegeknek abba kell hagyniuk a Janumet szedését és orvoshoz kell fordulniuk azonnal.
Az orvosoknak utasítania kell a betegeket, hogy a Janumet-kezelés megkezdése előtt olvassa el a betegtájékoztatót, és olvassa el minden alkalommal a recept megújításakor. A betegeket arra kell utasítani, hogy tájékoztassák orvosukat vagy gyógyszerészeiket, ha bármilyen szokatlan tünet jelentkezik, vagy ha bármely ismert tünet fennáll vagy súlyosbodik.
Laboratóriumi tesztek
Az összes diabéteszes kezelésre adott reakciót a vércukorszint és az A1C szint időszakos mérésével kell ellenőrizni, azzal a céllal, hogy ezeket a szinteket a normál tartományba csökkenjen. Az A1C különösen hasznos a hosszú távú glikémiás kontroll értékelésében.
A hematológiai paraméterek (például a hemoglobin / hematokrit és a vörös vér) kezdeti és időszakos ellenőrzése sejtindexeket) és a veseműködést (szérum kreatinin), legalább évente kell elvégezni. Noha a metformin-terápiában ritkán fordultak elő megaloblasztikus vérszegénység, annak gyanúja esetén ki kell zárni a B12-vitamin hiányát.
Forgalmazza:
MERCK & Co., Inc., Whitehouse Station, NJ 08889, USA
9794108
Amerikai egyesült államokbeli szabadalom: 6 699 871
1A MERCK & Co., Inc. bejegyzett védjegye, Whitehouse Station, New Jersey, 08889 USA
2 A MERCK & CO., Inc., Whitehouse Station, New Jersey 08889, védjegye
A 3GLUCOPHAGE® a Merck Sante S.A.S bejegyzett védjegye, a németországi Darmstadtban található Merck KGaA társult vállalkozása.
A Bristol-Myers Squibb Company engedéllyel rendelkezik.
SZERZŐI JOG © 2007, 2008 MERCK & CO., Inc.
Minden jog fenntartva
Az FDA által jóváhagyott betegcímkézés
Beteginformációk
Janumet® (JAN-you-met)
(szitagliptin / metformin HCl)
Tabletek
Mielőtt elkezdené szedni a gyógyszert, olvassa el a Janumet1-hez tartozó betegtájékoztatót, és minden alkalommal, amikor újratöltést kap. Lehet, hogy új információk is vannak. Ez a betegtájékoztató nem helyettesíti az orvosával az orvosi állapotáról vagy kezeléséről való beszélgetést.
Mi a legfontosabb információ, amit tudnom kell a Janumet-ről?
A metformin-hidroklorid, a Janumet egyik összetevője, ritka, de súlyos mellékhatást okozhat, az úgynevezett tejsavas acidózist (tejsav felhalmozódása a vérben), ami halált okozhat. A tejsavas acidózis orvosi sürgősség, amelyet kórházban kell kezelni.
Hagyja abba a Janumet szedését, és azonnal hívja orvosát, ha a tejsavas acidózis alábbi tüneteinek bármelyike jelentkezik:
- Nagyon gyenge és fáradt vagy.
- Szokatlan (nem normális) izomfájdalmad van.
- Nehezen lélegzik.
- Megmagyarázhatatlan gyomor- vagy bélproblémái vannak émelygéssel és hányással, vagy hasmenéssel.
- Hideg, különösen a karodban és a lábadban.
- Szédül vagy fejfájás.
- Lassú vagy szabálytalan szívverésed van.
Nagyobb esélye van tejsavas acidózis kialakulására, ha:
- veseproblémái vannak.
- májproblémái vannak.
- pangásos szívelégtelenségben szenved, amely gyógyszeres kezelést igényel.
- igyon sok alkoholt (nagyon gyakran vagy rövid távú „ingeres” ivás).
- kiszáradhat (nagy mennyiségű testnedvet veszíthet). Ez akkor fordulhat elő, ha lázban, hányásban vagy hasmenésben van. Dehidráció akkor fordulhat elő, ha aktív vagy testmozgással sokat izzad, és nem iszik elegendő folyadékot.
- végezzen bizonyos röntgenvizsgálatokat injektálható festékekkel vagy kontrasztanyagokkal.
- műtétük van.
- szívroham, súlyos fertőzés vagy stroke.
- 80 éves vagy annál idősebbek, és nem vizsgálták meg vesefunkcióját.
Mi a Janumet?
A Janumet tabletta két vényköteles gyógyszert tartalmaz, a szitagliptinet (JANUVIA ™ 2) és a metforminot. A Janumet étrenddel és testmozgással együtt alkalmazható a vércukorszint csökkentésére a 2. típusú cukorbetegségben szenvedő felnőtt betegeknél. Orvosa meghatározza, hogy a Janumet megfelelő-e Önnek, és meghatározza a legjobb módszert a cukorbetegség kezelésének megkezdésére és folytatására.
Janumetet:
- segít javítani az inzulin szintjét étkezés után.
- segít a testnek jobban reagálni az természetes inzulinra.
- csökkenti a szervezet által termelt cukor mennyiségét.
- valószínűtlen, hogy alacsony vércukorszinthez vezet (hipoglikémia), ha maga a vércukorszint kezelésére szolgál.
A Janumet alkalmazását 18 év alatti gyermekeken nem vizsgálták.
A Janumet-et nem vizsgálták olyan inzulinnal, amely gyógyszer ismert alacsony vércukorszint mellett.
Ki ne venné a Janumet-et?
Ne vegye be a Janumet-et, ha:
- 1. típusú cukorbetegségben szenved.
- bizonyos veseproblémái vannak.
- metabolikus acidózisnak vagy diabéteszes ketoacidózisnak nevezett állapotok vannak (megnövekedett ketonok a vérben vagy a vizeletben).
- allergiás reakciót váltottak ki a Janumet vagy a szitagliptin (JANUVIA), a Janumet egyik összetevője ellen.
- injekciót kapnak festékkel vagy kontrasztanyagokkal röntgeneljárásra, a Janumet-t egy rövid ideig le kell állítani. Beszéljen orvosával arról, mikor állítsa le a Janumet-et, és mikor kezdje újra. Lásd: "Mi a legfontosabb információ, amit tudnom kell a Janumet-ről?"
Mit kell mondanom az orvosomnak a Janumet-kezelés előtt és alatt?
A Janumet lehet, hogy nem megfelelő neked. Mondja el orvosának az összes egészségügyi állapotát, beleértve az alábbiakat:
- veseproblémái vannak.
- májproblémái vannak.
- allergiás reakciót váltottak ki a Janumet vagy a szitagliptin (JANUVIA), a Janumet egyik összetevője ellen.
- szívproblémái vannak, beleértve a pangásos szívelégtelenséget is.
- 80 évesnél idősebbek. A 80 év feletti betegek csak akkor vehetik be a Janumet-et, ha vesék működését ellenőrzik, és ez normális.
- sokat alkoholt inni (egész idő alatt vagy rövid ideig tartó „ingeres” ivás).
- terhes vagy terhességet tervez. Nem ismert, hogy a Janumet káros-e a születendő baba számára. Ha terhes, beszéljen orvosával a vércukorszint legjobb szabályozásának módjáról terhes állapotban. Ha a Janumet-et terhesség alatt használja, beszéljen orvosával arról, hogyan lehet a Janumet-nyilvántartásban. A terhesség-nyilvántartás díjmentes telefonszáma 1-800-986-8999.
- szoptat, vagy szoptatni tervezi. Nem ismert, hogy a Janumet bejut-e az anyatejbe. Beszéljen orvosával arról, hogy a legjobb módja lehet a csecsemő etetésének, ha Janumet-et szed.
Mondja el orvosának az összes alkalmazott gyógyszert, beleértve a vényköteles és vény nélkül kapható gyógyszereket, a vitaminokat és a gyógynövény-kiegészítőket. A Janumet befolyásolhatja a többi gyógyszer hatékonyságát, és néhány gyógyszer befolyásolhatja a Janumet hatékonyságát.
Ismerje meg a gyógyszereket. Vegyen fel listáját gyógyszereiről, és mutassa meg orvosának és gyógyszerészének, amikor új gyógyszert kap. Mielőtt bármilyen új gyógyszert elkezdené, beszéljen orvosával.
Hogyan kell bevenni a Janumet-t?
- Orvosa elmondja, hogy hány Janumet tablettát kell bevennie, és milyen gyakran kell bevennie őket. Pontosan úgy vegye be a Janumet-et, ahogyan az orvos elmondja.
- Lehet, hogy orvosának növelnie kell az adagot, hogy ellenőrizze a vércukorszintjét.
- Orvosa a Janumet-et egy szulfonilkarbamiddal (egy másik gyógyszer a vércukorszint csökkentésére) felírhatja. Lásd: "Melyek a Janumet lehetséges mellékhatásai?" az alacsony vércukorszint megnövekedett kockázatáról.
- A Janumet-et étkezés közben vegye be, hogy csökkentse a gyomorpanasz esélyét.
- Folytassa a Janumet szedését mindaddig, amíg orvosa előírja.
- Ha túl sok Janumet-et vett be, azonnal hívja orvosát vagy a mérgezési központot.
- Ha elmulaszt egy adagot, vegye be étellel, amint eszébe jut. Ha nem emlékszik, amíg nem érkezett ideje a következő adaghoz, hagyja ki a kihagyott adagot, és térjen vissza a szokásos ütemtervéhez. Ne vegyen be két adagot a Janumet-et egyszerre.
- Lehet, hogy egy rövid időre abba kell hagynia a Janumet szedését. Hívja orvosát az utasításokért, ha:
- kiszáradtak (túl sok testnedvet veszítettek el). Dehidráció akkor fordulhat elő, ha súlyos hányással, hasmenéssel vagy lázkal jár, vagy ha a normálnál sokkal kevesebb folyadékot iszik.
- tervezni fogja műtétét.
- injekciót kapnak festékkel vagy kontrasztanyaggal röntgeneljárásra.
Lásd: "Mi a legfontosabb információ, amit tudnom kell a Janumet-ről?" és "Ki ne vegye be a Janumet-et?"
- Ha a tested bizonyos típusú stressz, például láz, trauma (például autóbaleset), fertőzés vagy műtét alatt van, a diabétesz gyógyszer mennyisége megváltozhat. Azonnal értesítse orvosát, ha ezen állapotok valamelyike fennáll, és kövesse orvosának utasításokat.
- Ellenőrizze a vércukorszintjét, amint azt orvosa előírja.
- A Janumet szedése közben tartsa be az előírt diétát és a testmozgási programot.
- Beszéljen orvosával arról, hogyan lehet megelőzni, felismerni és kezelni az alacsony vércukorszint (hipoglikémia), magas vércukorszint (hiperglikémia) és a cukorbetegség szövődményeit.
- Orvosa rendszeres vérvizsgálattal ellenőrzi a cukorbetegségét, beleértve a vércukorszintjét és az A1C hemoglobin szintjét.
- Orvosa vérvizsgálatot végez a veseműködés ellenőrzésére a Janumet-kezelés előtt és alatt.
Melyek a Janumet lehetséges mellékhatásai?
A Janumet súlyos mellékhatásokat okozhat. Lásd: "Mi a legfontosabb információ, amit tudnom kell a Janumet-ről?"
A Janumet szedésekor gyakori mellékhatások a következők:
- füstös vagy orrfolyás és torokfájás
- felső légúti fertőzés
- hasmenés
- hányinger és hányás
- gáz, gyomor kellemetlen érzés, emésztési zavarok
- gyengeség
- fejfájás
A Janumet étkezés közben történő bevétele csökkentheti a metformin gyakori gyomor mellékhatásait, amelyek általában a kezelés elején jelentkeznek. Ha szokatlan vagy váratlan gyomorproblémái vannak, beszéljen orvosával. A kezelés során később jelentkező gyomorproblémák valami súlyosabb jele lehet.
Egyes cukorbetegség elleni gyógyszerek, például a szulfonilkarbamidok és a meglitinidek alacsony vércukorszinthez vezethetnek (hipoglikémia). Amikor a Janumet-et ezekkel a gyógyszerekkel együtt alkalmazzák, túl alacsony lehet a vércukorszintje. Orvosa alacsonyabb dózisokat írhat fel a szulfonilurea vagy meglitinid gyógyszerre. Mondja el orvosának, ha problémái vannak az alacsony vércukorszinttel.
A következő további mellékhatásokról számoltak be a Janumet vagy szitagliptin általános alkalmazásával kapcsolatban:
- Súlyos allergiás reakciók fordulhatnak elő a Janumet vagy a szitagliptin esetében, amely a Janumet egyik gyógyszere. A súlyos allergiás reakció tünetei között szerepelhet kiütés, csalánkiütés és az arc, az ajkak, a nyelv és a torok duzzanata, légzési vagy nyelési nehézségek. Ha allergiás reakciója van, hagyja abba a Janumet szedését, és azonnal hívja orvosát. Orvosa felírhat gyógyszert az allergiás reakció kezelésére, valamint más gyógyszert a cukorbetegség kezelésére.
- Megnövekedett májenzimek.
- Hasnyálmirigy-gyulladás.
Ez nem a Janumet összes lehetséges mellékhatása. További információkért forduljon orvosához.
Mondja el orvosának, ha olyan mellékhatása van, amely zavar, szokatlan vagy nem szűnik meg.
Hogyan kell tárolni a Janumet-et?
Tárolja a Janumet-t szobahőmérsékleten, 20-25 ° C-on.
Tartsa a Janumet-et és az összes gyógyszert gyermekektől elzárva.
Általános információk a Janumet alkalmazásáról
Időnként gyógyszereket írnak fel olyan betegségek esetén, amelyeket a betegtájékoztatók nem említenek. Ne használja a Janumet olyan állapotban, amelyre nem írta elő. Ne adjon Janumet-et másoknak, még akkor is, ha ugyanazok a tünetek vannak, mint Önnek. Árthat nekik.
Ez a szórólap összefoglalja a Janumettel kapcsolatos legfontosabb információkat. Ha további információt szeretne tudni, beszéljen orvosával. Kérdezze meg orvosát vagy gyógyszerészét a Janumetről az egészségügyi szakemberek számára írt információkkal. További információ az 1-800-622-4477 telefonszámon.
Milyen összetevők vannak a Janumet-ben?
Hatóanyagok: szitagliptin és metformin-hidroklorid.
Inaktív összetevők: mikrokristályos cellulóz, polivinilpirrolidon, nátrium-lauril-szulfát és nátrium-sztearil-fumarát. A tabletta filmbevonat a következő inaktív összetevőket tartalmazza: polivinil-alkohol, polietilénglikol, talkum, titán-dioxid, vörös vas-oxid és fekete vas-oxid.
Mi a 2. típusú cukorbetegség?
A 2-es típusú cukorbetegség olyan állapot, amikor a test nem készít elegendő mennyiségű inzulint, és a test által termelt inzulin nem működik olyan jól, mint kellene. A teste is túl sok cukrot tud előállítani. Amikor ez megtörténik, cukor (glükóz) halmozódik fel a vérben. Ez súlyos orvosi problémákhoz vezethet.
A cukorbetegség kezelésének fő célja az, hogy a vércukorszintet normális szintre csökkentse. A vércukorszint csökkentése és szabályozása elősegítheti vagy késleltetheti a cukorbetegség szövődményeit, például szívproblémákat, veseproblémákat, vakságot és amputációt.
A magas vércukorszintet csökkentheti a diéta és a testmozgás, valamint egyes gyógyszerek, ha szükséges.
Kiadva: 2009. március
Forgalmazza:
MERCK & Co., Inc., Whitehouse Station, NJ 08889, USA
Utolsó frissítés: 03/09
Janumet, szitagliptin és metformin-hidroklorid, betegtájékoztató (egyszerűen angolul)
Részletes információ a cukorbetegség jeleiről, tüneteiről, okairól, kezeléséről
Az ebben a monográfiában szereplő információknak nem célja az összes lehetséges felhasználás, utasítások, óvintézkedések, gyógyszerkölcsönhatások vagy káros hatások lefedése. Ez az információ általános, és nem célja speciális orvosi tanácsadás. Ha kérdése van a használt gyógyszerekkel kapcsolatban, vagy további információt szeretne, keresse fel orvosát, gyógyszerészét vagy ápolóját.
vissza a: Keresse meg a cukorbetegség kezelésére szolgáló összes gyógyszert



