Apidra cukorbetegség kezelésére
Márkanév: Apidra
Általános név: Glulizin inzulin
Az Apidra (glulizin inzulin) mesterségesen előállított termék, amely majdnem azonos az emberi inzulinnal. Cukorbetegség kezelésére alkalmazzák. Használat, adagolás, mellékhatások.
Tartalom:
Javallatok és felhasználás
Adagolás és adminisztráció
Ellenjavallatok
Figyelmeztetések és óvintézkedések
Mellékhatások
Gyógyszerkölcsönhatások
Felhasználás meghatározott populációkban
túladagolás
Leírás
Klinikai farmakológia
Nemklinikai toxikológia
Klinikai vizsgálatok
Hogyan szállították
Apidra, glutin inzulin, betegtájékoztató (egyszerűen angolul)
Jelzések
Az Apidra egy gyorsan ható humán inzulin analóg, amely javítja a cukorbetegségben szenvedő felnőttek és gyermekek glikémiás szabályozását.
felső
Adagolás és adminisztráció
Adagolási szempontok
Az APIDRA egy rekombináns inzulin analóg, amely ekvpotenciális az emberi inzulinnal (azaz az APIDRA egy egységének ugyanolyan glükózcsökkentő hatása van, mint a szokásos humán inzulin egy egységének), ha intravénásan adják be. Subcutan adva az APIDRA gyorsabban hat, és rövidebb időtartamú, mint a szokásos humán inzulin.
Az APIDRA adagolását individualizálni kell. A vércukorszint ellenőrzése elengedhetetlen minden inzulinterápiában részesülő betegnél.
A teljes napi inzulinigény változhat, és általában 0,5-1 egység / kg / nap között lehet. Az inzulinszükséglet megváltozhat stressz, súlyos betegség, valamint a testmozgás, étkezési szokások vagy együttesen beadott gyógyszerek változásakor.
Szubkután alkalmazás
Az APIDRA-t étkezés előtt 15 percen belül vagy az étkezés megkezdését követő 20 percen belül kell beadni.
A szubkután injekcióval beadott APIDRA-t általában köztes vagy hosszú hatású inzulinnal kell alkalmazni.
Az APIDRA-t subcutan injekcióval kell beadni a hasfalba, a combba vagy a felkarba. Az injekció beadásának helyét ugyanabban a régióban (has, comb vagy felkar) az egyik injekciótól a másikig kell elforgatni a lipodisztrófia kockázatának csökkentése érdekében. MELLÉKHATÁSOK].
Folyamatos szubkután infúzió (inzulinpumpa)
Az APIDRA beadható folyamatos szubkután infúzió formájában a hasfalban. Ne használjon hígított vagy vegyes inzulint a külső inzulinpumpakban. Az infúziós helyeket ugyanabban a régióban kell elforgatni a lipodystrophia kockázatának csökkentése érdekében MELLÉKHATÁSOK]. A külső inzulin infúziós pumpa kezdeti programozásának az előző kezelési rend teljes napi inzulinadagján kell alapulnia.
A következő inzulinpumpakat használták az APIDRA klinikai vizsgálatokban, amelyeket a sanofi-aventis, az APIDRA gyártója végeztek:
- Disetronic® H-Tron®, valamint V100 és D-Tron® Disetronic katéterekkel (Rapid ™, Rapid C ™, Rapid D ™ és Tender ™)
- MiniMed® 506, 507, 507c és 508 modellek MiniMed katéterekkel (Sof-set Ultimate QR ™ és Quick-set ™).
Mielőtt egy másik inzulinszivattyút APIDRA-val használna, olvassa el a szivattyú címkét, hogy megbizonyosodjon arról, hogy a szivattyút az APIDRA-val értékelte-e.
Az orvosoknak és a betegeknek körültekintően kell értékelniük a szivattyúhasználatra vonatkozó információkat az APIDRA felírási útmutatójában, a betegtájékoztatóban és a szivattyúgyártó kézikönyvében. Az APIDRA-specifikus információkat figyelembe kell venni a felhasználás ideje, az infúziós készletek cseréjének gyakorisága vagy más szempont alapján az APIDRA használatára vonatkozó részletek, mivel az APIDRA-specifikus információk eltérhetnek az általános szivattyú-kézikönyvtől utasítás.
A tartósítószer, a metakrezol és az inzulin lebomlását kimutató in vitro vizsgálatok alapján az APIDRA-t a tartályban legalább 48 óránként kell cserélni. Klinikai alkalmazásban lévő APIDRA nem szabad kitéve 37 ° C-ot meghaladó hőmérsékleten. [Lát FIGYELMEZTETÉSEK ÉS ÓVINTÉZKEDÉSEK és HOGYAN KELL SZOLGÁLTATNI / Tárolás és kezelés].
Intravénás alkalmazás
Az APIDRA intravénásán beadható glikémiás ellenőrzés céljából orvosi felügyelet mellett, a vércukorszint és a szérum kálium szoros monitorozásával a hipoglikémia és a hipokalemia elkerülése érdekében. Intravénás alkalmazásra az APIDRA-t 0,05 egység / ml - 1 egység / ml koncentrációban kell alkalmazni glulizin inzulinként infúziós rendszerekben, poli (vinil-klorid) (PVC) tasakokkal. Az APIDRA csak normál sóoldatban (0,9% nátrium-klorid) stabil. A parenterális gyógyszerkészítményeket a beadás előtt szemrevételezéssel kell ellenőrizni, hogy nem tartalmaz-e részecskéket és elszíneződést. Ne adjon be intravénásan az inzulinkeverékeket.
Adagolási formák és erősségek
Az Apidra 100 egység / ml (U-100) az alábbi formában kapható:
- 10 ml-es fiolák
- 3 ml-es patron az OptiClik alkalmazásához® Inzulin szállító eszköz
- 3 ml SoloStar előretöltött injekciós toll
felső
Ellenjavallatok
Az Apidra ellenjavallt:
- hipoglikémia epizódjai során
- olyan betegeknél, akik túlérzékenyek az Apidra vagy bármely segédanyagával szemben
Az Apidra vagy annak segédanyagaival szembeni túlérzékenység esetén betegeknél lokalizált vagy generalizált túlérzékenységi reakciók alakulhatnak ki [lásd Mellékhatások].
felső
Figyelmeztetések és óvintézkedések
Az adagolás módosítása és ellenőrzése
A glükóz ellenőrzése elengedhetetlen az inzulinterápiában részesülő betegek számára. Az inzulinkezelést óvatosan és csak orvosi felügyelet mellett kell megváltoztatni. Az inzulinerősség, a gyártó, a típus vagy az alkalmazás módjának megváltozása szükségessé teheti az inzulin adagjának megváltoztatását. Az egyidejű orális antidiabetikus kezelést szükség lehet módosítani.
Mint minden inzulinkészítmény esetében, az Apidra működési ideje különböző egyénekben vagy különböző időpontokban változhat ugyanazon egyén, és számos körülménytől függ, beleértve az injekció beadásának helyét, a helyi vérellátást vagy a helyi hőfok. Azoknak a betegeknek, akik megváltoztatják a fizikai aktivitás szintjét vagy az étkezési tervet, szükség lehet az inzulin adagjának módosítására.
A hipoglikémia
A hipoglikémia az inzulinterápia leggyakoribb mellékhatása, beleértve az Apidrat is. A szigorúbb glikémiás kontroll növeli a hypoglykaemia kockázatát. A betegeket oktatni kell a hypoglykaemia felismerésére és kezelésére. A súlyos hipoglikémia eszméletvesztést és / vagy görcsöket okozhat, és átmeneti vagy tartós agyi funkciók károsodásához vagy halálához vezethet. Súlyos hypoglykaemia, amely más személy segítségét igényli, és / vagy parenterális glükózinfúzió vagy a glükagon beadását megfigyelték az inzulinnal végzett klinikai vizsgálatokban, ideértve a Apidra.
A hipoglikémia időzítése általában az alkalmazott inzulinkészítmények idő-hatás profilját tükrözi. Más tényezők, mint például az étkezés változása (például az étkezés mennyisége vagy az étkezés időzítése), az injekció beadásának helyszíne, a testmozgás és az egyidejű gyógyszerek szintén megváltoztathatják a hipoglikémia kockázatát. Gyógyszerkölcsönhatások].
Mint minden inzulin esetében, vigyázzon, ha a hypoglykaemia ismeretlen és a betegek esetleg ilyenek hipoglikémia szempontjából hajlamosak (például a gyermekpopulációra és azokra a betegekre, akik éhesek vagy szokásos táplálkozással rendelkeznek) bevitel). A hypoglykaemia miatt csökkent lehet a beteg koncentrálódási és reakcióképessége. Ez kockázatot jelenthet olyan helyzetekben, ahol ezek a képességek különösen fontosak, mint például a vezetés vagy más gépek kezelése.
A szérum glükózszintjének gyors változásai cukorbetegségben szenvedő személyeknél hypoglykaemiahoz hasonló tüneteket válthatnak ki, a glükózértékétől függetlenül. A hipoglikémia korai előrejelző tünetei bizonyos körülmények között eltérőek vagy kevésbé lehetnek kifejezettek, mint például a régóta fennálló cukorbetegség, diabéteszes idegbetegség, gyógyszerek, például béta-blokkolók használata [Lásd Gyógyszerkölcsönhatások], vagy fokozott cukorbetegség-szabályozás. Ezek a helyzetek súlyos hypoglykaemiahoz (és esetleg eszméletvesztéshez) vezethetnek, mielőtt a beteg tudatában lenne a hipoglikémiának.
Az intravénásán adagolt inzulin hatása gyorsabban indul, mint a szubkután beadott inzulin, ezért a hipoglikémia fokozottabb ellenőrzése szükséges.
Túlérzékenység és allergiás reakciók
Súlyos, életveszélyes, általános allergia, beleértve az anafilaxiát, inzulintermékekkel, köztük az Apidraval [lásd Mellékhatások].
hypokalemia
Az összes inzulintermék, beleértve az Apidrat is, a kálium eltolódását idézi elő az extracelluláris és az intracelluláris térben, ami hypokalemiahoz vezethet. A kezeletlen hypokalemia légzőszervi bénulást, kamrai aritmiát és halált okozhat. Vigyázatossággal járjon olyan betegek esetén, akiknél fennáll a hypokalemia veszélye (pl. Káliumszint-csökkentő gyógyszereket használó betegek, a szérum káliumkoncentrációra érzékeny gyógyszereket szedő betegek). Az Apidra intravénás beadásakor gyakran ellenőrizze a glükózt és a káliumot.
Vese- vagy májkárosodás
Vesekárosodásban vagy májkárosodásban szenvedő betegeknél szükség lehet a glükóz gyakori ellenőrzésére és az inzulin adagjának csökkentésére Klinikai farmakológia].
Inzulinok keverése
A szubkután injekcióhoz szükséges Apidra-t nem szabad keverni az NPH-inzulin kivételével. Ha az Apidrat NPH-inzulinnal keverik, először az Apidrat kell behúzni a fecskendőbe. Az injekciót közvetlenül a keverés után kell elvégezni.
Intravénás beadásra vagy folyamatos szubkután infúziós pumpában való alkalmazásra ne keverje az Apidra-t más inzulinnal.
Az intravénás alkalmazásra szánt Apidra-t nem szabad 0,9% -os nátrium-klorid oldattal (normál sóoldat) hígítani. Az Apidra hígítószerekkel vagy más inzulinnal való összekeverésének hatékonyságát és biztonságosságát a külső szubkután infúziós pumpákban nem igazolták.
Szubkután inzulin infúziós pumpák
Külső inzulinszivattyúban történő alkalmazáskor az Apidra-t nem szabad hígítani vagy keverni semmilyen más inzulinnal. A tartályban lévő Apidra-t legalább 48 óránként ki kell cserélni. Az Apidra nem szabad kitéve 37 ° C-nál magasabb hőmérsékleten.
Az inzulinpumpa vagy az infúziós készlet hibás működése vagy az inzulin lebomlása gyorsan hiperglikémiához és ketózishoz vezethet. A hiperglikémia vagy a ketózis okának azonnali azonosítása és kiigazítása szükséges. Időközi subcutan injekcióra lehet szükség Apidra-val. A folyamatos szubkután inzulin infúziós pumpakezelést alkalmazó betegeket fel kell képezni az inzulin injekció beadására, és alternatív inzulinterápiával kell rendelkezniük a pumpa meghibásodása esetén. [Lát Adagolás és adminisztráció, Hogyan szállítják / tárolják és kezelik].
Intravénás alkalmazás
Amikor az Apidra-t intravénásan adják be, a glükóz- és káliumszintet gondosan ellenőrizni kell, hogy elkerülhető legyen a végzetes hipoglikémia és a hipokalemia.
Intravénás alkalmazásra ne keverje az Apidra-t más inzulinnal. Az Apidra csak normál sóoldatban hígítható.
Gyógyszerkölcsönhatások
Egyes gyógyszerek megváltoztathatják az inzulinigényt és a hypoglykaemia vagy hiperglikémia kockázatát Gyógyszerkölcsönhatások].
felső
Mellékhatások
A következő mellékhatásokat másutt tárgyalják:
- Hipoglikémia [lásd Figyelmeztetések és óvintézkedések]
- Hypokalemia [Lásd Figyelmeztetések és óvintézkedések]
Klinikai vizsgálati tapasztalatok
Mivel a klinikai vizsgálatokat széles skálán hajtják végre, az egyik klinikai vizsgálatban jelentett mellékhatások valószínűleg nem könnyen összehasonlíthatók egy másik klinikai vizsgálatban bejelentett arányokkal, és nem tükrözhetik a klinikai ténylegesen megfigyelt arányokat gyakorlat.
Az Apidra klinikai vizsgálatok során az 1. típusú cukorbetegségben és a 2. típusú cukorbetegségben szenvedő betegek körében végzett káros mellékhatások gyakoriságát az alábbi táblázatok sorolják fel.
1. táblázat: Kezelés - előforduló mellékhatások az 1. típusú cukorbetegségben szenvedő felnőttekkel végzett összesített vizsgálatokban (≥ 5% gyakoriságú mellékhatások)
| APIDRA,% (N = 950) |
Minden összehasonlítóegy, % (N = 641) |
|
| nasopharyngitis | 10.6 | 12.9 |
| A hipoglikémiab | 6.8 | 6.7 |
| Felső légúti fertőzés | 6.6 | 5.6 |
| Influenza | 4.0 | 5.0 |
|
egy Lispro inzulin, normál humán inzulin, aszpart inzulin b Csak súlyos tüneti hypoglykaemia |
2. táblázat: Kezelés - elkerülhető mellékhatások 2-es típusú cukorbetegségben szenvedő felnőttek összesített tanulmányaiban (nemkívánatos események gyakorisága â ‰% 5%)
| APIDRA,% (N = 883) |
Rendszeres humán inzulin,% (N = 883) |
|
| Felső légúti fertőzés | 10.5 | 7.7 |
| nasopharyngitis | 7.6 | 8.2 |
| Ödéma perifériás | 7.5 | 7.8 |
| Influenza | 6.2 | 4.2 |
| Ízületi | 5.9 | 6.3 |
| Magas vérnyomás | 3.9 | 5. |
- Gyermekgyógyászat
A 3. táblázat összefoglalja a klinikai vizsgálatban az 5% -nál nagyobb gyakorisággal előforduló mellékhatásokat APIDRA-val (n = 277) vagy lispro inzulinnal kezelt 1. típusú cukorbetegségben szenvedő gyermekek és serdülőknél (N = 295).
3. táblázat: Kezelés - elkerülhetetlen mellékhatások 1. típusú cukorbetegségben szenvedő gyermekeknél és serdülőknél (mellékhatások gyakorisága â ‰% 5%)
| APIDRA,% (N = 277) |
Lispro,% (N = 295) |
|
| nasopharyngitis | 9.0 | 9.5 |
| Felső légúti fertőzés | 8.3 | 10.8 |
| Fejfájás | 6.9 | 11.2 |
| Hipoglikémiás rohamok | 6.1 | 4.7 |
- Súlyos tüneti hypoglykaemia
Az hypoglykaemia a leggyakrabban megfigyelt mellékhatás az inzulint használó betegekben, beleértve az Apidrat is [lásd Figyelmeztetések és óvintézkedések]. A súlyos tüneti hipoglikémia gyakorisága és előfordulása - amelyet harmadik fél beavatkozását igénylő hipoglikémiaként definiáltak - valamennyi kezelési rend esetében összehasonlítható volt (lásd a 4. táblázatot). A 3. fázisú klinikai vizsgálatban az 1. típusú cukorbetegségben szenvedő gyermekeknél és serdülőknél gyakrabban fordultak elő súlyos tüneti hypoglykaemia a két kezelési csoportban az 1. típusú felnőttekhez képest cukorbetegség. (lásd a 4. táblázatot) Klinikai vizsgálatok].
4. táblázat: Súlyos tüneti hipoglikémia *
| 1. típusú cukorbetegség felnőttek 12 hét glargin inzulinnal |
1. típusú cukorbetegség felnőttek 26 hét glargin inzulinnal |
2-es típusú diabétesz felnőttek 26 hét NPH humán inzulinnal |
1. típusú cukorbetegség gyermekgyógyászat 26 hét |
||||||
|---|---|---|---|---|---|---|---|---|---|
| Apidra Étkezés előtti |
Apidra Étkezés utáni |
Rendszeres emberi inzulin | Apidra | Lispro inzulin | Apidra | Rendszeres emberi inzulin | Apidra | Insulin Lispr | |
| * Súlyos tüneti hipoglikémia, amelyet hipoglikémiás eseményként határoznak meg, amely másik személy segítségét igényli, és amely megfelel az alábbi kritériumok egyikének: az eseményhez a teljes vérben hivatkozott vércukorszint <36 mg / dl volt társítva, vagy az esemény orális szénhidrát, intravénás glükóz vagy glükagon alkalmazás után az azonnali gyógyulással társult. | |||||||||
| Havi események betegenként | 0.05 | 0.05 | 0.13 | 0.02 | 0.02 | 0.00 | 0.00 | 0.09 | 0.08 |
| A betegek százaléka (n / összes N) | 8.4% (24/286) | 8.4% (25/296) | 10.1% (28/278) | 4.8% (16/339) |
4.0% (13/333) |
1.4% (6/416) |
1.2% (5/420) |
16.2% (45/277) |
19.3% (57/295) |
- Az inzulin indítása és a glükózkontroll fokozása
A glükózkontroll fokozódása vagy gyors javulása átmenetileg visszafordíthatóvá vált szemészeti refrakciós rendellenesség, a diabéteszes retinopathia súlyosbodása és akut fájdalmas perifériás neuropátia. A hosszú távú glikémiás kontroll azonban csökkenti a diabéteszes retinopathia és a neuropathia kockázatát.
- lipodystrophia
Az inzulin, beleértve az Apidrat, hosszú távú használata lipodisztrófiát okozhat az ismételt inzulin injekciók vagy infúziók helyén. A lipodisztrófia magában foglalja a lipohipertrófiát (a zsírszövet megvastagodása) és a lipoatrofiát (a zsírszövet megvastagodása), és befolyásolhatja az inzulin felszívódását. Forgassa el az inzulin injekciós vagy infúziós helyeket ugyanabban a régióban, hogy csökkentse a lipodystrophia kockázatát. [Lát Adagolás és adminisztráció].
- Súlygyarapodás
Súlynövekedés előfordulhat az inzulinterápiával, beleértve az Apidrat is, és ennek tulajdonítható az inzulin anabolikus hatásai és a glükózuria csökkenése.
- Perifériás ödéma
Az inzulin, beleértve az Apidrat is, nátrium-visszatartást és ödémát okozhat, különösen, ha az intenzív inzulinterápia javítja a korábban rossz anyagcsere-szabályozást.
- Mellékhatások folyamatos szubkután inzulin infúzióval (CSII)
Egy 12 hetes randomizált vizsgálatban 1. típusú cukorbetegségben szenvedő betegekben (n = 59) a katéter aránya az elzáródások és az infúziós hely reakciói hasonlóak voltak az Apidra-val és az aszpart inzulinnal kezelt betegeknél (5. táblázat).
5. táblázat: Katéter elzáródások és az infúziós hely reakciói.
| Apidra (N = 29) |
aszpart inzulin (N = 30) |
|
|---|---|---|
| Katéter elzáródások / hónap | 0.08 | 0.15 |
| Infúziós helyre adott reakciók | 10.3% (3/29) | 13.3% (4/30) |
- Allergiás reakciók
Helyi allergia
Mint minden inzulinterápia, az Apidrat szedő betegeknél bőrpír, duzzanat vagy viszketés tapasztalható az injekció beadásának helyén. Ezek a kisebb mellékhatások általában néhány naptól néhány hétig oldódnak meg, de bizonyos esetekben szükség lehet az Apidra abbahagyására. Bizonyos esetekben ezek a reakciók az inzulintől eltérő tényezőkkel is összefügghetnek, például a bőrtisztító szer irritáló hatásaival vagy a rossz injekciós technikával.
Szisztémás allergia
Súlyos, életveszélyes, általános allergia, beleértve az anafilaxiát, bármilyen inzulinnal, beleértve az Apidrat is, előfordulhat. Az általános inzulin allergia allergiát okozhat az egész testben (beleértve a viszketést), légszomjat, zihálást, hypotoniát, tachycardiát vagy diafézist.
Legfeljebb 12 hónapos, ellenőrzött klinikai vizsgálatokban 79 eset közül 79-ben jelentettek lehetséges szisztémás allergiás reakciókat 1833 beteg (4,3%), akik Apidra-t kaptak, és 1524 beteg közül 58 (3,8%) kapta az összehasonlító rövid hatású inzulinok. Ezekben a vizsgálatokban az Apidra-kezelést 1833 beteg közül 1-ben véglegesen abbahagyták a lehetséges szisztémás allergiás reakció miatt.
Lokális reakciókat és generalizált myalgiákat jelentettek metakrezol alkalmazásával, amely az Apidra segédanyaga.
Antitest előállítás
Egy 1. típusú cukorbetegségben szenvedő betegekben végzett vizsgálatban (n = 333) az emberi inzulinnal és az inzulinnal egyaránt reagáló inzulin antitestek koncentrációi a glulizin (keresztreakciós inzulin antitestek) a kiindulási szint közelében maradt a vizsgálat első 6 hónapjában a Apidra. Az antitest koncentráció csökkenését figyelték meg a vizsgálat következő 6 hónapjában. Egy 2. típusú cukorbetegségben szenvedő betegekben (n = 411) végzett vizsgálatban a keresztreakciós inzulin antitest koncentráció hasonló növekedése volt a megfigyelték az Apidra-val kezelt betegeknél és az emberi inzulinnal kezelt betegek körében az tanulmány. Ezt követően az antitestek koncentrációja csökkent az Apidra betegekben és stabil maradt a humán inzulin betegekben. Nem volt összefüggés a keresztreakciós inzulin antitest koncentráció és a HbA1c, az inzulin dózisok és a hypoglykaemia előfordulása között. Ezen antitestek klinikai jelentősége nem ismert.
Az Apidra nem vált ki szignifikáns antitestválaszt egy 1. típusú cukorbetegségben szenvedő gyermekek és serdülők vizsgálatában.
Postmarketing tapasztalat
Az Apidra jóváhagyást követő alkalmazása során az alábbi mellékhatásokat azonosították.
Mivel ezekről a reakciókról önkéntesen számolnak be a bizonytalan méretű népességből, nem az mindig lehetséges megbízhatóan megbecsülni gyakoriságukat, vagy megállapítani az okozati összefüggést a droggal kitettség.
Gyógyszeres hibákról számoltak be, amelyekben véletlenül más inzulinokat, különösen hosszú hatású inzulinokat adtak be Apidra helyett.
felső
Gyógyszerkölcsönhatások
Számos gyógyszer befolyásolja a glükóz-anyagcserét, és szükségessé teheti az inzulin adagjának módosítását és különösen a szoros ellenőrzést.
Az olyan gyógyszerek, amelyek fokozhatják az inzulinok, köztük az Apidra, vércukorszint-csökkentő hatását, és ezért növelik a hipoglikémia kockázatát, magukban foglalják az orális antidiabetikus készítményeket, pramlintide, ACE-gátlók, disopiramid, fibrátok, fluoxetin, monoamin-oxidáz-gátlók, propoxifen, pentoxifillin, szalicilátok, szomatosztatin analógok és szulfonamid antibiotikumok.
Az Apidra vércukorszint-csökkentő hatását csökkentő gyógyszerek közé tartoznak a kortikoszteroidok, niacin, danazol, diuretikumok, szimpatomimetikumok (például epinefrin, albuterol, terbutalin), glukagon, izoniazid, fenotiazin-származékok, szomatropin, pajzsmirigyhormonok, ösztrogének, progesztogének (például orális fogamzásgátlókban), proteázgátlók és atipikus antipszichotikumok.
A béta-blokkolók, klonidin, lítiumsók és alkohol növelhetik vagy csökkenthetik az inzulin vércukorszint-csökkentő hatását.
A pentamidin hipoglikémiát okozhat, amelyet néha hiperglikémia követhet.
A hipoglikémia jelei csökkenhetnek vagy hiányozhatnak olyan betegeknél, akik anti-adrenerg gyógyszereket, például béta-blokkolókat, klonidint, guanetidint és rezerpint szednek.
felső
Felhasználás meghatározott populációkban
Terhesség
C kategóriájú terhesség: A glulizin inzulinnal reprodukciós és teratológiai vizsgálatokat végeztek patkányokon és nyulakon, normál humán inzulinnal összehasonlítva. A nőstény patkányok számára a glulizint inzulint adták a terhesség alatt, subcutan dózisban, napi egyszeri 10 egység / kg-ig (az adag az expozíció az ember átlagos dózisának kétszeresére, a testfelület összehasonlításán alapulva), és az embrió-magzatra nem volt figyelemre méltó toxikus hatás fejlesztés.
A glulizin inzulint nőstény nyulaknak adták a terhesség alatt, legfeljebb 1,5 subcutan dózisban Mértékegységek / kg / nap (az a dózis, amely a test felületének az átlagos emberi dózisának 0,5-szerese expozíciót eredményez összehasonlítás). Az embrió-magzati fejlődésre gyakorolt káros hatások csak az anyai toxikus dózisszinteknél voltak megfigyelhetők, ami hipoglikémiát indukált. A beültetés utáni veszteségek és a csontvázkárosodások gyakoribb előfordulását figyelték meg napi egyszeri 1,5 egység / kg dózisnál (dózis ami az emberi átlagos dózisnak a testfelület összehasonlításán alapuló expozíciójának 0,5 - szerese), amely szintén a halálozást okozta gátak. A beültetés utáni veszteségek enyhe megnövekedett gyakoriságát figyelték meg a napi egyszeri 0,5 egység / kg alsó dózisszint mellett (az adag 0,2 az ember átlagos dózisának a testfelület összehasonlításán alapuló szorzata), amely szintén súlyos hypoglykaemiahoz társult, de abban nem voltak hibák dózis. A nyulak napi egyszeri 0,25 egység / kg dózisánál nem figyeltek meg hatást (a dózis az expozíciót eredményezte, az ember átlagos dózisának 0,1-szerese a testfelület összehasonlításával). A glulizin inzulin hatásai nem különböztek a szubkután szokásos humán inzulinnal azonos adagokban észlelt hatásoktól, és az anyai hypoglykaemia másodlagos hatásainak tulajdoníthatók.
Nincs jól kontrollált klinikai vizsgálat az Apidra terhes nőkön történő alkalmazásáról. Mivel az állatokon végzett szaporodási vizsgálatok nem mindig előrejelzik az emberi választ, ezt a gyógyszert csak akkor szabad alkalmazni terhesség alatt, ha a lehetséges előny igazolja a magzatra gyakorolt potenciális kockázatot. A cukorbetegségben vagy a terhességi cukorbetegségben szenvedő betegek számára elengedhetetlen a jó metabolikus kontroll fenntartása a fogamzás előtt és a terhesség alatt. Az inzulinszükséglet csökkenthet az első trimeszterben, általában növekszik a második és harmadik trimeszterben, és gyorsan csökkenhet a szülés után. Ezekben a betegekben elengedhetetlen a glükózkontroll gondos ellenőrzése.
Szoptató anyák
Nem ismert, hogy a glulizin inzulin kiválasztódik-e az anyatejbe. Mivel sok gyógyszer kiválasztódik az anyatejbe, ezért körültekintően kell eljárni, amikor az Apidrat szoptató nőnek adják be. Az Apidra használata összeegyeztethető a szoptatással, de cukorbetegeknek, akik szoptatnak, szükség lehet az inzulin adagjának módosítására.
Gyermekgyógyászati alkalmazás
Az Apidra szubkután injekciók biztonságosságát és hatékonyságát megállapították az 1. típusú cukorbetegségben szenvedő gyermekkori betegekben (4–17 éves korban). Klinikai vizsgálatok]. Az Apidra-t nem vizsgálták 4 évesnél fiatalabb 1. típusú cukorbetegségben szenvedő gyermekgyógyászati betegekben és 2. típusú cukorbetegségben szenvedő gyermekkori betegekben.
A felnőttekhez hasonlóan az Apidra adagolását gyermekkori betegekben az anyagcserének és a vércukorszint gyakori monitorozásának függvényében individualizálni kell.
Geriátriai alkalmazás
Klinikai vizsgálatokban (n = 2408) az Apidra-t 147 betegnek adták be, 65 éves korukban és 27 betegnek, 75 éves kortól. Az idős betegek e kis részének nagy része 2-es típusú cukorbetegségben szenvedett. A HbA1c értékek és a hipoglikémia gyakoriságának változása koronként nem különbözött egymástól. Ennek ellenére óvatosan kell eljárni, amikor az Apidra-t geriatrikus betegeknek adják be.
felső
túladagolás
A felesleges inzulin hypoglykaemiát, és különösen intravénás alkalmazás esetén hypokalemia-t okozhat. Enyhe hypoglykaemia epizódok általában orális glükózzal kezelhetők. Szükség lehet a gyógyszeradag módosítására, az étkezési szokásokra vagy a testmozgásra. Kómával, rohamokkal vagy neurológiai károsodásokkal járó súlyosabb hypoglykaemia epizódok kezelhetők intramuszkuláris / szubkután glükagonnal vagy koncentrált intravénás glükózzal. Fenntartható szénhidrátbevitelre és megfigyelésre lehet szükség, mivel a hipoglikémia megismétlődik a nyilvánvaló klinikai gyógyulás után. A hipokalémiát megfelelően ki kell javítani.
Leírás
Az Apidra® (glulizin inzulin [rDNS eredetű injekció) egy gyors hatású humán inzulin analóg, amelyet a vércukorszint csökkentésére használnak. A glulizin inzulint rekombináns DNS-technológiával állítják elő, az Escherichia coli (K12) nem-patogén laboratóriumi törzsét felhasználva. A glulizin inzulin abban különbözik a humán inzulintól, hogy az aszparagin aminosavat a B3 helyzetben lizin és a B29 helyzetben lévő lizin helyettesíti a glutaminsav. Kémiai szempontból a glulizin inzulin 3B-lizin-29B-glutaminsav-humán inzulin, amelynek empirikus képlete C258H384N64O78S6, molekulatömege 5823, és a következő szerkezeti képlettel rendelkezik:
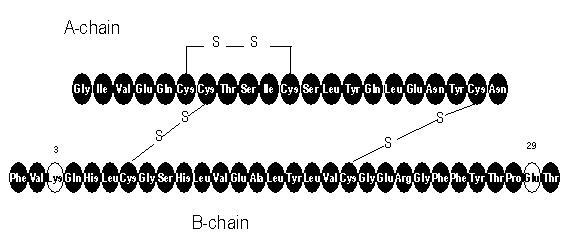
Az Apidra egy steril, vizes, tiszta és színtelen oldat. Az Apidra milliliterje 100 egység (3,49 mg) glulizin inzulint, 3,15 mg metakrezolt, 6 mg trometaminot, 5 mg nátrium-kloridot, 0,01 mg poliszorbátot 20 és injekcióhoz való vizet tartalmaz. Az Apidra pH-ja megközelítőleg 7,3. A pH-t sósav és / vagy nátrium-hidroxid vizes oldatának hozzáadásával állíthatjuk be.
felső
Klinikai farmakológia
A cselekvés mechanizmusa
Az inzulinok és inzulin-analógok, köztük a glulizin inzulin elsődleges tevékenysége a glükóz-metabolizmus szabályozása. Az inzulinok csökkentik a vér glükózszintjét azáltal, hogy stimulálják a vázizom és zsír perifériás glükózfelvételét, és gátolják a máj glükóztermelését. Az inzulinok gátolják a lipolízist és a proteolízist, és fokozzák a fehérje szintézist.
Az Apidra és a szokásos humán inzulin glükózszintjét csökkentő tevékenységei egyenértékűek, ha intravénásan adják be őket. Szubkután alkalmazás után az Apidra hatása gyorsabb, és rövidebb ideig tart, mint a szokásos humán inzulin. [Lásd a Farmakodinámiát].
Gyógyszerhatástani
Egészséges önkéntesekkel és cukorbetegekkel végzett vizsgálatok azt mutatták, hogy az Apidra gyorsabb a hatás megindulása és az aktivitás rövidebb időtartama, mint a szokásos humán inzulin adagolásakor szubkután.
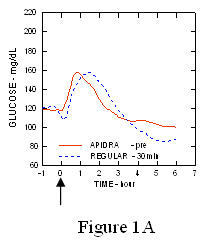
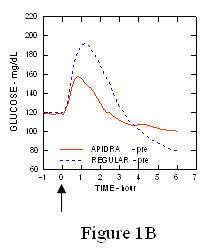
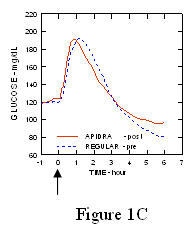
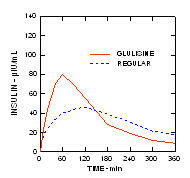
Egy 1. típusú cukorbetegségben szenvedő betegekben végzett vizsgálatban (n = 20) az Apidra és a szokásos humán inzulint különböző időpontokban értékelték a szokásos étkezéshez viszonyítva, 0,15 dózisban Egység / kg. (1.ábra.)
A maximális vércukorszint-elvezetés (Î ”GLUmax; a kiindulási vonalból kivont glükózkoncentráció) az étkezés előtt 2 perccel injektált Apidra-ban 65 mg / dL volt, szemben a normál ember 64 mg / dL-ével 30 perccel étkezés előtt injektált inzulin (lásd az 1A. ábrát), és 84 mg / dL a normál humán inzulinhoz, amelyet 2 perccel étkezés előtt adnak be (lásd az ábrát). 1B). Az étkezés kezdete után 15 perccel injektált Apidra vércukorszintje maximálisan 85 volt mg / dL, szemben a normál humán inzulin 84 mg / dL értékével, étkezés előtt 2 perccel injektálva (lásd a 6. ábrát) 1C).
1.ábra. Az Apidra és a szokásos humán inzulin egyszeri adagja után 6 óráig gyűjtött átlagos vércukorszint. Az Apidra étkezés megkezdése előtt 2 perccel (Apidra - pre) adott a normál humán inzulinnal szemben, amelyet 30 perccel adtak be (Regular - 30 perc) az étkezés megkezdése előtt (1A. ábra) és összehasonlítva a normál humán inzulinnal (Regular - pre), amelyet étkezés előtt 2 perccel adnak (ábra 1B). Az Apidra étkezés kezdete után 15 perccel (Apidra - poszt) kapott, összehasonlítva a normál humán inzulinnal (Regular - pre), étkezés előtt 2 perccel (1C ábra). Az x tengelyen nulla (0) a 15 perces étkezés kezdete.
 |
 |
 |
 |
Egy randomizált, nyílt, kétirányú kereszteződéses vizsgálatban 16 egészséges férfi alany részesült intravénásan Apidra vagy szokásos humán inzulin infúziója sóoldat-hígítóval, 0,8 milliUn / kg / perc sebességgel két órák. Ugyanazon adag Apidra vagy szokásos humán inzulin infúziója egyenértékű glükózkibocsátást eredményezett egyensúlyi állapotban.
farmakokinetikája
Felszívódás és biohasznosulás
Egészséges önkéntesek és cukorbetegek (1. vagy 2. típusú) farmakokinetikai profiljai azt mutatták, hogy a glulizin inzulin felszívódása gyorsabb volt, mint a szokásos humán inzuliné.
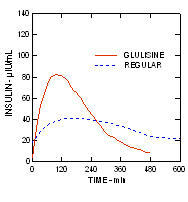
Egy 1. típusú cukorbetegségben szenvedő betegekben (n = 20) végzett vizsgálat során 0,15 egység / kg szubkután beadást követően a medián idő a maximális koncentrációig (Tmax) 60 perc volt (40-120 perc) és a csúcskoncentráció (Cmax) 83 mikroegység / ml (40-131 mikroegység / ml tartományban volt) a glulizin inzulinnál. összehasonlítva a normál ember átlagos Tmax-értékével 120 perc (60–239 perc) és a Cmax-vel 50 mikroegység / ml (35–71 mikroegység / ml tartományban) inzulin. (2. ábra)
2. ábra. Az inzulin glulizin és a normál humán inzulin farmakokinetikai profiljai 1. típusú cukorbetegségben szenvedő betegek esetén 0,15 egység / kg dózis után.
A glulizin inzulint és a szokásos humán inzulint szubkután adták be 0,2 egység / kg dózisban euglikémiás clamp vizsgálat 2-es típusú cukorbetegségben (n = 24), testtömeg-index (BMI) 20 és 36 között kg / m2. A maximális koncentráció (Tmax) elérésének medián ideje 100 perc (40-120 perc), a csúcskoncentráció (Cmax) pedig 84 mikroegység / ml (tartományban 53-165 mikroegység / ml). a glulizin inzulin esetében a normál humán inzulin Tmax mediánja 240 perc (80-360 perc) és a Cmax 41 mikroegység / ml (tartomány: 33-61 mikroEgység / ml) összehasonlításakor. (3. ábra)
3. ábra. A glulizin inzulin és a szokásos humán inzulin farmakokinetikai profiljai 2-es típusú cukorbetegségben szenvedő betegeknél 0,2 egység / kg szubkután adag után.
Amikor az Apidrat szubkután injektálták a test különböző területeire, az időkoncentráció profilja hasonló volt. A glulizin inzulin abszolút biohasznosulása szubkután alkalmazás után körülbelül 70%, az injekció beadásának területétől függetlenül (has 73%, deltális 71%, comb 68%).
Egészséges önkéntesekkel végzett klinikai vizsgálatban (n = 32) a glulizin inzulin teljes biohasznosulása szubkután után hasonló volt. a glulizin inzulint és az NPH inzulint (előretöltve a fecskendőbe) és külön egyidejű szubkután injekcióval kell beadni injekciót. Az előkeverés után 27% -kal csökkent az Apidra maximális koncentrációja (Cmax); azonban a maximális koncentráció eléréséig eltelt idő (Tmax) nem változott. Nem állnak rendelkezésre adatok az Apidra és az NPH inzulin kivételével az egyéb inzulinkészítményekkel való keverésről. [Lát Klinikai vizsgálatok].
Terjesztés és kiküszöbölés
A glulizin inzulin és a normál humán inzulin eloszlása és eliminációja intravénás alkalmazás után az adagolás hasonló a 13 és 21 L eloszlási térfogat, a felezési idő pedig a 13 és 17 perc alatt, illetőleg. Subcutan alkalmazás után a glulizin inzulin gyorsabban ürül ki, mint a szokásos humán inzulin, látszólagos felezési ideje 42 perc, szemben a 86 perccel.
Klinikai farmakológia meghatározott populációkban
Gyermekgyógyászati betegek
Az Apidra és a szokásos humán inzulin farmakokinetikai és farmakodinamikai tulajdonságait a vizsgálat 7–11 éves (n = 10) és 12–16 éves serdülőknél (n = 10), 1. típusú cukorbetegség. Az Apidra és a szokásos humán inzulin farmakokinetikájának és farmakodinámiájának relatív különbségei ezek az 1. típusú cukorbetegségben szenvedő betegek hasonlóak voltak az egészséges felnőtt és 1-es típusú felnőtteknél cukorbetegség.
Verseny
A 24 egészséges kaukázusi és japán alanyban végzett vizsgálat összehasonlította a glulizin, a lispro inzulin és a szokásos humán inzulin szubkután injekciójának farmakokinetikáját és farmakodinamikáját. A glulizin inzulin szubkután injektálásával a japán egyének nagyobb kezdeti expozícióval rendelkeztek (33%) az AUC (0-1h) és az AUC (0-szoros vég) arányához viszonyítva, mint a kaukázusi (21%), bár a teljes kitettség hasonló. Hasonló megállapítások voltak a lispro inzulinnal és a normál humán inzulinnal.
Elhízottság
A glulizin inzulint és a szokásos humán inzulint subcutan adták be 0,3 egység / kg dózisban, a euglikémiás szorongásos vizsgálat elhízott, nem cukorbetegekben (n = 18), testtömeg-mutatóval (BMI) 30 és 40 között kg / m2. A maximális koncentráció (Tmax) elérésének medián időtartama 85 perc (49–150 perc) és a csúcskoncentráció (Cmax) 192 mikroEgység / ml (98–380 mikroegység / ml tartomány). a glulizin inzulin esetén a normál ember átlagos Tmax-értéke 150 perc (90–240 perc) és a Cmax 86 mikroegység / ml (tartományban 43–175 mikroegység / ml) inzulin.
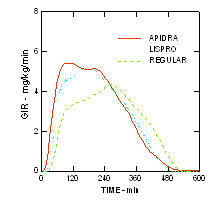
Az Apidra és a lispro inzulin gyorsabb fellépése és rövidebb időtartamú aktivitása a szokásos humán inzulinhoz képest fennmaradt az elhízott, nem cukorbetegségben szenvedő populációban (n = 18). (4. ábra)
4. ábra. Glükóz-infúziós sebesség (GIR) euglikémiás clamp vizsgálatban 0,3 egység / kg Apidra, lispro inzulin vagy szokásos humán inzulin subcutan injekcióját követően elhízott populációban.
Vesekárosodás
A humán inzulinnal végzett vizsgálatok megnövekedett keringési szintet mutattak veseelégtelenségben szenvedő betegekben. Egy 24 nem diabéteszes, normál vesefunkciójú (ClCr> 80 ml / perc), közepesen súlyos vesekárosodásban (30-50 ml / perc) és súlyos vesekárosodásban szenvedő (nem figyelhető meg és óvintézkedések) betegen végzett vizsgálatban.
Májkárosodás
A májkárosodásnak az Apidra farmakokinetikájára és farmakodinámiájára gyakorolt hatását nem vizsgálták. Néhány humán inzulinnal végzett vizsgálat kimutatta, hogy májkárosodásban szenvedő betegek körében megnövekedett az inzulinszint. [Lát Figyelmeztetések és óvintézkedések].
nem
A nemeknek az Apidra farmakokinetikájára és farmakodinámiájára gyakorolt hatását nem vizsgálták.
Terhesség
A terhességnek az Apidra farmakokinetikájára és farmakodinámiájára gyakorolt hatását nem vizsgálták.
Dohányzó
A dohányzásnak az Apidra farmakokinetikájára és farmakodinámiájára gyakorolt hatását nem vizsgálták.
felső
Nemklinikai toxikológia
Karcinogenezis, mutagenezis, a termékenység romlása
2 éves karcinogenitási vizsgálatokat állatokon nem végeztek el. Sprague Dawley patkányokon 12 hónapos ismételt dózisú toxicitási vizsgálatot végeztek glulizin inzulinnal, 2,5, 5, 20 vagy 50 egység / kg naponta kétszer (a dózis az emberi átlagos dózisnak a testfelület alapján 1, 2, 8 és 20-szoros expozícióját eredményezi) összehasonlítás).
A nőstény patkányokban glulizin inzulint kapó emlődaganatok dózisfüggő, nem kezelt kontrollokhoz viszonyított magasabb incidenciája volt a kezeletlen kontrollokhoz képest. Az emlődaganatok gyakorisága hasonló volt a glulizin inzulinhoz és a normál humán inzulinhoz. E megállapítások relevanciája az emberekre nem ismert. A glulizin inzulin nem volt mutagén a következő tesztekben: Ames-teszt, in vitro emlős kromoszóma aberrációs teszt V79 kínai hörcsögsejtekben és in vivo emlős vörösvértest mikronukleusz-teszt patkányokban.
Termékenységi vizsgálatokban hím és nőstény patkányokon, napi egyszeri 10 egység / kg-ig terjedő szubkután dózisokon (az adag az átlagos ember kétszeresének való expozíciót eredményezi) adag, a testfelület összehasonlításán alapul), a férfiak és nők termékenységére, illetve az állatok általános szaporodási teljesítményére nem mutattak egyértelmű káros hatást megfigyelt.
felső
Klinikai vizsgálatok
Az Apidra biztonságosságát és hatékonyságát felnőtt és 1. és 2. típusú cukorbetegségben szenvedő betegekben (n = 1833), valamint 1. típusú cukorbetegségben szenvedő gyermekeknél és serdülőkorú betegekben (4-17 év) (n = 572) vizsgálták. Ezekben a vizsgálatokban az elsődleges hatékonysági paraméter a glikémiás kontroll volt, amelyet glikált hemoglobin (HHA1c ekvivalensen jelentett GHb) alkalmazásával értékeltek.
1. típusú cukorbetegség - felnőttek
26 hetes, randomizált, nyílt, aktív, kontrollált, nem alacsonyabbrendűségű vizsgálatot végeztek 1. típusú cukorbetegségben szenvedő betegekben a az Apidra (n = 339) biztonságossága és hatékonysága a lispro inzulinnal (n = 333) összehasonlítva, ha szubkután adják be a étkezés. A glargin inzulint naponta egyszer adták be este, mint bazális inzulint. A randomizálás előtt 4 hetes bejáratási időszak volt a lispro inzulinnal és a glargin inzinnel. A legtöbb beteg kaukázusi (97%) volt. A betegek 58% -a volt férfi. Az átlagéletkor 39 év volt (18 és 74 év között). A glikémiás kontroll, a napi rövid hatású inzulin injekciók száma és az Apidra és a lispro inzulin teljes napi dózisa hasonló volt a két kezelési csoportban (6. táblázat).
6. táblázat: 1. típusú diabetes mellitus - felnőtt
| A kezelés időtartama Kezelés a következőkkel kombinálva: |
26 hét Glargin inzulin |
|
|---|---|---|
| Apidra | Lispro inzulin | |
| ||
| Glikált hemoglobin (GHb)* (%) | ||
| Betegek száma | 331 | 322 |
| Kiindulási átlag | 7.6 | 7.6 |
| Kiigazított átlagváltozás a kiindulási értékhez képest | -0.1 | -0.1 |
| Kezelési különbség: Apidra - Lispro inzulin | 0.0 | |
| 95% CI kezelési különbség esetén | (-0.1; 0.1) | |
| Alapvető inzulin adag (egység / nap) | ||
| Kiindulási átlag | 24 | 24 |
| Kiigazított átlagváltozás a kiindulási értékhez képest | 0 | 2 |
| Rövid hatású inzulin adag (egység / nap) | ||
| Kiindulási átlag | 30 | 31 |
| Kiigazított átlagváltozás a kiindulási értékhez képest | -1 | -1 |
| Rövid hatású inzulin injekciók átlagos száma naponta | 3 | 3 |
| Testtömeg (kg) | ||
| Kiindulási átlag | 73.9 | 74.1 |
| Átlagos változás a kiindulási értékhez képest | 0.6 | 0.3 |
2. típusú cukorbetegség - felnőttek
26 hetes, randomizált, nyílt, aktív, kontrollált, nem alacsonyabbrendűségű vizsgálatot végeztek inzulinnal kezelt, 2. típusú cukorbetegekben a az Apidra (n = 435) biztonságossága és hatékonysága étkezés előtt 15 percen belül, összehasonlítva a szokásos humán inzulinnal (n = 441), amelyet 30–45 perccel azelőtt adtak be étkezés. Az NPH humán inzulint naponta kétszer adták alapszintű inzulinként. Az összes beteg 4 hetes bejutási időszakban vett részt normál humán inzulinnal és NPH humán inzulinnal. A betegek nyolcvanöt százaléka kaukázusi, 11% -a feketében volt. Az átlagéletkor 58 év volt (26-84 év). Az átlagos testtömeg-index (BMI) 34,6 kg / m2 volt. Véletlenszerűsítéskor a betegek 58% -a vett orális antidiabetikumot. Ezeket a betegeket arra utasították, hogy a vizsgálat ideje alatt folytassák orális antidiabetikus szerek alkalmazását ugyanabban az adagban. A betegek többsége (79%) közvetlenül az injekció beadása előtt keverte rövid hatású inzulinját az NPH humán inzulinnal. A GHb kezdeti szinthez viszonyított csökkenése hasonló volt a két kezelési csoportban (lásd a 7. táblázatot). Nem volt különbség az Apidra és a szokásos humán inzulincsoportok között a napi rövid hatású inzulin injekciók számában, illetve az alap- vagy rövid hatású inzulin adagokban. (Lásd a 7. táblázatot.)
7. táblázat: 2. típusú diabetes mellitus-felnőttkor
| A kezelés időtartama | 26 hét | |
|---|---|---|
| Kezelés a következőkkel kombinálva: | NPH humán inzulin | |
| Apidra | Rendszeres emberi inzulin | |
| ||
| Glikált hemoglobin (GHb)* (%) | ||
| Betegek száma | 404 | 403 |
| Kiindulási átlag | 7.6 | 7.5 |
| Kiigazított átlagváltozás a kiindulási értékhez képest | -0.5 | -0.3 |
| Kezelési különbség: Apidra - rendszeres humán inzulin | -0.2 | |
| 95% CI kezelési különbség esetén | (-0.3; -0.1) | |
| Alapvető inzulin adag (egység / nap) | ||
| Kiindulási átlag | 59 | 57 |
| Kiigazított átlagváltozás a kiindulási értékhez képest | 6 | 6 |
| Rövid hatású inzulin adag (egység / nap) | ||
| Kiindulási átlag | 32 | 31 |
| Kiigazított átlagváltozás a kiindulási értékhez képest | 4 | 5 |
| Rövid hatású inzulin injekciók átlagos száma naponta | 2 | 2 |
| Testtömeg (kg) | ||
| Kiindulási átlag | 100.5 | 99.2 |
| Átlagos változás a kiindulási értékhez képest | 1.8 | 2.0 |
1. típusú cukorbetegség - felnőttek: étkezés előtti és utáni alkalmazás
12 hetes, randomizált, nyílt, aktív, kontrollált, nem alacsonyabbrendűségű vizsgálatot végeztek 1. típusú cukorbetegség az Apidra biztonságosságának és hatékonyságának felmérése céljából, különböző időpontokban alkalmazva az a étkezés. Az Apidrat szubkután adták be, akár étkezés előtt 15 percen belül (n = 286), akár közvetlenül a étkezést (n = 296) és a szokásos humán inzulint (n = 278) adtunk be szubkután, 30–45 perccel a étkezés. A glargin inzulint naponta egyszer, lefekvéskor adták be alapinzulinként. 4 hetes bejáratási időszak volt a normál humán inzulinnal és a glargin inzinnel, amelyet randomizálás követett. A legtöbb beteg kaukázusi (94%) volt. Az átlagéletkor 40 év volt (18 és 73 év között). A glikémiás kontroll (lásd a 8. táblázatot) összehasonlítható volt a 3 kezelési rend esetében. A rövid hatású inzulin injekciók teljes napi számában a kezelések között nem tapasztaltak változást a kezdeti szinthez képest. (Lásd a 8. táblázatot.)
8. táblázat: Táplálkozás előtti és utáni alkalmazás az 1. típusú cukorbetegség felnőttkorában
| A kezelés időtartama Kezelés a következőkkel kombinálva: |
12 hét glargin inzulin |
12 hét glargin inzulin |
12 hét glargin inzulin |
|---|---|---|---|
| Apidra étkezés előtt |
Apidra étkezés utáni |
Rendszeres emberi inzulin | |
| |||
| Glikált hemoglobin (GHb)* (%) | |||
| Betegek száma | 268 | 276 | 257 |
| Kiindulási átlag | 7.7 | 7.7 | 7.6 |
| Kiigazított átlagváltozás a kiindulási értékhez képest†| -0.3 | -0.1 | -0.1 |
| Alapvető inzulin adag (egység / nap) | |||
| Kiindulási átlag | 29 | 29 | 28 |
| Kiigazított átlagváltozás a kiindulási értékhez képest | 1 | 0 | 1 |
| Rövid hatású inzulin adag (egység / nap) | |||
| Kiindulási átlag | 29 | 29 | 27 |
| Kiigazított átlagváltozás a kiindulási értékhez képest | -1 | -1 | 2 |
| Rövid hatású inzulin injekciók átlagos száma naponta | 3 | 3 | 3 |
| Testtömeg (kg) | |||
| Kiindulási átlag | 79.2 | 80.3 | 78.9 |
| Átlagos változás a kiindulási értékhez képest | 0.3 | -0.3 | 0.3 |
1. típusú cukorbetegség és gyermekkori betegek
26 hetes, randomizált, nyílt, aktív, kontrollált, nem alacsonyabbrendűségű vizsgálatot végeztek 4 évesnél idősebb gyermekeknél és serdülőknél, 1. típusú cukorbetegség az Apidra (n = 277) biztonságosságának és hatékonyságának felmérése érdekében, összehasonlítva a lispro inzulinnal (n = 295), ha szubkután, 15 percen belül étkezés. A betegek glargin inzulint (napi egyszeri adagolás este) vagy NPH inzulint kaptak (reggel egyszer és este egyszer). A randomizálás előtt 4 hetes bejáratási periódus volt a lispro inzulinnal és a glargin inzulinnal vagy NPH-val. A legtöbb beteg kaukázusi (91%) volt. A betegek ötven százaléka férfi volt. Az átlagéletkor 12,5 év volt (4-17 év). Az átlagos BMI 20,6 kg / m2 volt. A glikémiás kontroll (lásd a 9. táblázatot) összehasonlítható volt a két kezelési rend esetében.
9. táblázat: 26 hetes vizsgálat eredményei 1. típusú diabetes mellitusban szenvedő gyermekgyógyászati betegekben
| Apidra | A lispro | |
|---|---|---|
| Betegek száma | 271 | 291 |
| Alapvető inzulin | NPH vagy glargin inzulin | NPH vagy glargin inzulin |
| ||
| Glikált hemoglobin (GHb)* (%) | ||
| Kiindulási átlag | 8.2 | 8.2 |
| Kiigazított átlagváltozás a kiindulási értékhez képest | 0.1 | 0.2 |
| Kezelési különbség: Átlagos (95% -os konfidencia intervallum) | -0.1 (-0.2, 0.1) | |
| Alapvető inzulin adag (egység / kg / nap) | ||
| Kiindulási átlag | 0.5 | 0.5 |
| Átlagos változás a kiindulási értékhez képest | 0.0 | 0.0 |
| Rövid hatású inzulin adag (egység / kg / nap) | ||
| Kiindulási átlag | 0.5 | 0.5 |
| Átlagos változás a kiindulási értékhez képest | 0.0 | 0.0 |
| Rövid hatású inzulin injekciók átlagos száma naponta | 3 | 3 |
| Kiindulási átlagos testtömeg (kg) | 51.5 | 50.8 |
| Átlagos súlyváltozás a kiindulási értékhez képest (kg) | 2.2 | 2.2 |
1. típusú cukorbetegség - felnőttek: Folyamatos szubkután inzulin infúzió
Egy 12 hetes randomizált, aktív kontroll vizsgálat (Apidra versus aspart inzulin), amelyet 1. típusú cukorbetegségben szenvedő felnőtteknél végeztek (Apidra n = 29, aspart inzulin = 30) értékelte az Apidra alkalmazását külső folyamatos szubkután inzulinban szivattyú. Az összes beteg kaukázusi volt. Az átlagéletkor 46 év volt (21–73 év). Az átlagos GHb mindkét kezelési csoportban növekedett a kiindulási ponttól a végpontig (6,8% -ról 7,0% -ra az Apidra esetében; 7,1% -ról 7,2% -ra az aszpart inzulin esetében).
felső
Hogyan szállítják / tárolják és kezelik
Hogyan szállították
| |
| Az Apidra 100 egység / ml (U-100) az alábbi formában kapható: | |
| 10 ml-es fiolák | NDC 0088-2500-33 |
| 3 ml-es patronrendszer*, 5 csomag | NDC 0088-2500-52 |
| 3 ml SoloStar előretöltött injekciós toll, 5 darab csomag | NDC 0088-2502-05 |
A tolltűk nem tartoznak a csomagolásba.
Az OptiClikkel együtt használható BD Ultra-Fine ™ tolltűket1 külön kapják, és a Becton Dickinson és a Company gyártják.
A Solostar kompatibilis a Becton Dickinson and Company, a Ypsomed és az Owen Mumford összes tűjével.
Tárolás
A lejárati idő után ne alkalmazza (lásd a dobozt és a tartályt).
Bontatlan injekciós üveg / patronrendszer / SoloStar
Bontatlan Apidra injekciós üvegeket, patronrendszereket és a SoloStar-t hűtőszekrényben, 2 ° C-8 ° C (36 ° F-46 ° F) hőmérsékleten kell tárolni. Védje a fénytől. Az Apidra-t nem szabad fagyasztóban tárolni, és nem szabad fagyasztani. Dobja el, ha fagyott.
Nem nyitott injekciós üvegeket / patronrendszereket / a hűtőszekrényben nem tárolt SoloStar-ot 28 napon belül fel kell használni.
Nyitott (használat közbeni) injekciós üveg:
A nyitott fiolákat, hűtve vagy nem, 28 napon belül fel kell használni. Ha a hűtés nem lehetséges, akkor a használatban lévő nyitott fiolát legfeljebb 28 napig hűtve lehet tartani a közvetlen hőtől és fénytől, mindaddig, amíg a hőmérséklet nem haladja meg a 25 ° C-ot.
Nyitott (használatban lévő) patronrendszer:
Az OptiClik®-be behelyezett nyitott (használatban lévő) patronrendszert NEM szabad hűteni, hanem 25 ° C (77 ° F) hőmérsékleten tartandó közvetlen hőtől és fénytől. A nyitott (használatban lévő) patronrendszert 28 nap elteltével el kell dobni. Soha ne tárolja az OptiClik®-t patronrendszerrel vagy anélkül hűtőszekrényben.
Nyitott (használatban lévő) SoloStar előretöltött toll:
A nyitott (használatban lévő) SoloStar-t NEM szabad hűteni, hanem 25 ° C (77 ° F) hőmérsékleten tartandó közvetlen hőtől és fénytől. A szobahőmérsékleten tartott nyitott (használatban lévő) SoloStar-ot 28 nap elteltével el kell dobni.
Infúziós készletek:
Az infúziós készleteket (tartályokat, csöveket és katétereket), valamint a tartályban lévő Apidra-t 48 órás használat után vagy 37 ° C-ot meghaladó hőmérsékleten történő kitétel után el kell dobni.
Intravénás alkalmazás:
Infúziós zacskók, elkészítve az alábbiak szerint ADAGOLÁS ÉS ADMINISZTRÁCIÓ szobahőmérsékleten 48 órán keresztül stabilak.
Előkészítés és kezelés
Az intravénás alkalmazásra történő hígítás után az oldatot a beadás előtt szemrevételezéssel ellenőrizni kell, hogy tartalmaz-e részecskéket és elszíneződést. Ne használja az oldatot, ha zavaros vagy részecskéket tartalmaz; Csak akkor használja, ha tiszta és színtelen. Az Apidra nem kompatibilis a Dextrose oldattal és a Ringers oldattal, ezért nem használható ezekkel az oldat-folyadékokkal. Az Apidra más oldatokkal történő alkalmazását még nem vizsgálták, ezért nem ajánlott.
Patronrendszer: Ha az OptiClik® (az Apidra inzulinszállító eszköz) hibásan működik, akkor az Apidra kihúzható a patronrendszerből egy U-100 fecskendőbe és befecskendezhető.
Apidra, glutin inzulin, betegtájékoztató (egyszerűen angolul)
Utoljára frissítve: 02/2009
Részletes információ a cukorbetegség jeleiről, tüneteiről, okairól, kezeléséről
Az ebben a monográfiában szereplő információknak nem célja az összes lehetséges felhasználás, utasítások, óvintézkedések, gyógyszerkölcsönhatások vagy káros hatások lefedése. Ez az információ általános, és nem célja speciális orvosi tanácsadás. Ha kérdése van a használt gyógyszerekkel kapcsolatban, vagy további információt szeretne, keresse fel orvosát, gyógyszerészét vagy ápolóját.
vissza a: Keresse meg a cukorbetegség kezelésére szolgáló összes gyógyszert



